- Azoxymethan
-
Strukturformel 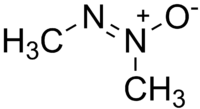
Allgemeines Name Azoxymethan Andere Namen - Dimethyldiazen-1-oxid
- (Z)-Methyl-O,N,N-azoxymethan
Summenformel C2H6N2O CAS-Nummer 25843-45-2 PubChem 33184 Kurzbeschreibung Flüssigkeit
Eigenschaften Molare Masse 74,08 g·mol−1 Dichte 0,991 g·cm−3[1]
Siedepunkt 97–99 °C[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [1] 


Gefahr
H- und P-Sätze H: 226-300-315-319-350 EUH: keine EUH-Sätze P: 201-264-301+310-305+351+338-308+313 [1] EU-Gefahrstoffkennzeichnung [1]
T
GiftigR- und S-Sätze R: 45-46-10-25-36/38 S: 53-26-36/37/39-45 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Azoxymethan (AOM) ist eine krebserregende Flüssigkeit und ein Derivat von Azomethan.
Krebserregende Wirkung
Azoxymethan ist stark krebserregend. Bei Nagetieren induziert die Gabe von Azoxymethan spezifisch die Entstehung von kolorektalen Karzinomen.[2] Die Läsionen entsprechen dabei der Kolonkarzinogenese beim Menschen.[3] Aus diesem Grund wird Azoxymethan in der Onkologie zur Induktion von Darmkrebs in Versuchstieren verwendet. Dazu wird die Verbindung meist subkutan oder intraperitoneal verabreicht.[4]
In der Leber wird Azoxymethan als Stoffwechselprodukt durch die Oxidation von 1,2-Dimethylhydrazin (DMH) gebildet. DMH ist somit das Prokarzinogen von Azoxymethan. Azoxymethan wird in der Leber weiter zu Methylazoxymethanol (MAM) umgewandelt. MAM wird glucuronisiert und gelangt über die Galle letztlich in den Darm. Das dort vorhandene Enzym β-Glucuronidase hydrolysiert das Konjugat wieder zu MAM. Die β-Glucuronidase kann dabei sowohl aus den Bakterien der Darmflora, als auch aus den Darmepithelzellen stammen. Methylazoxymethanol zerfällt bei 37 °C mit einer Halbwertszeit von 12 Stunden in N-Methylnitrosamin und ein Methylradikal.[5] Das Methylradikal kann die DNA im Zellkern zu 6-O-Methylguanin alkylieren.[6][7] Wird die Schädigung der DNA nicht behoben, so führt die Methylierung bei der Replikation zu einer Transition von Guanin nach Adenin, die durch eine Fehlbindung von 6-O-Methylguanin mit Thymin hervorgerufen wird.[8]
Synthese
Azoxymethan lässt sich beispielsweise elektrochemisch aus Nitromethan herstellen.[9]
Einzelnachweise
- ↑ a b c d e Datenblatt Azoxymethan bei Sigma-Aldrich, abgerufen am 9. März 2011.
- ↑ H. Druckrey: Production of colon carcinoma by 1,2-dimethylhydrazines ans axozyalkanes. In: Carcinoma of the colon and antecedent epithelium. Walter J. Burdette (Editor), W. J. Thomas Books, Springfield, 1970, S. 578–579.
- ↑ J. H. Weisburger und E. S. Fiala: Experimental colon carcinogens and their mode of action. In: Experimental colon carcinogenesis H. Autrup (Editor), Boca Raton, 1983, S. 27–50.
- ↑ A. Bissahoyo, R. S. Pearsall, K. Hanlon, V. Amann, D. Hicks, V. L. Godfrey, D. W. Threadgill: Azoxymethane is a genetic background-dependent colorectal tumor initiator and promoter in mice: effects of dose, route, and diet. In: Toxicol Sci 88, 2005, S. 340–345. PMID 16150884
- ↑ H. T. Nagasawa, F. N. Shirota, H. Matsumoto: Decomposition of methylazoxymethanol, the aglycone of cycasin, in D2O. In: Nature 236, 1972, S. 234–235. PMID 4553643
- ↑ D. C. Herron und R. C. Shank: DNA methylation during chronic administration of 1,2-dimethylhydrazine in a carcinogenic regimen. In: Carcinogenesis 3, 1982, S. 857–860. PMID 7127668
- ↑ A. E. Pegg und T. L. Byers: Repair of DNA containing O6-alkylguanine. In: Faseb J 6, 1992, S: 2302–2310. PMID 1544541 (Review)
- ↑ C. Fähndrich: Wirkung von Apfelsaft auf die Kolonkarzinogenese und deren Modulation durch Wachstumsfaktoren im Tierexperiment. Dissertation, Tierärztliche Hochschule Hannover, 2005
- ↑ P. E. Iversen: Organische Elektrosynthesen, IV. Darstellung von Azoxymethan und 1,2-Dimethyl-hydrazin aus Nitromethan und von Azoxycyclopropan aus Nitrocyclopropan. In: Chemische Berichte 104, 1971, S. 2195–2198. doi:10.1002/cber.19711040719
Kategorien:- Giftiger Stoff
- Krebserzeugender Stoff
- Erbgutverändernder Stoff
- Onkologie
- Azoverbindung
- Aminoxid
Wikimedia Foundation.
