- Nitrosubstituierte Phenole
-
Die nitrosubstituierten Phenole bilden in der Chemie eine größere Gruppe aromatischer Nitro-Verbindungen, die sich vom Phenol ableiten. Sie sind zumeist durch Nitrierung von Phenol mit (konzentrierter) Salpetersäure zugänglich. Viele Verbindungen fallen durch ihre intensive gelbe Farbe auf. Je nach Zahl der Nitrogruppen unterscheidet man zwischen den (Mono-)Nitrophenolen, von denen drei Konstitutionsisomere existieren, Dinitrophenolen mit sechs isomeren Verbindungen, von denen hauptsächlich 2,4-Dinitrophenol praktische Bedeutung hat. Unter den Trinitrophenolen ist der wichtigste Vertreter das 2,4,6-Trinitrophenol mit dem Trivialnamen Pikrinsäure.
Je nach Substitutionsgrad mit Nitrogruppen unterscheidet man zwischen:
- (Mono-)Nitrophenole (drei isomere Verbindungen), C6H5NO3
- Dinitrophenole (sechs isomere Verbindungen), C6H4N2O5
- Trinitrophenole (sechs isomere Verbindungen), C6H3N3O7
- Tetranitrophenole (drei isomere Verbindungen), C6H2N4O9
- Pentanitrophenol, C6HN5O11
Inhaltsverzeichnis
Eigenschaften
Acidität
verschiedene Nitrophenole und ihre pKs-Werte Name Phenol 4-Nitrophenol 2,4-Dinitrophenol Pikrinsäure Strukturformel 

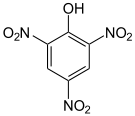
pKs-Wert[1] 9,99 7,16 4,09 0,29 Der schwach saure Charakter des Phenols ist durch die Mesomeriestabilisierung des Phenolat-Ions zu begründen. Die Nitrogruppen wirken elektronenziehend; die phenolische OH-Bindung wird zunehmend polarisiert. Mit zunehmendem Grad der Nitrierung nimmt die Säurestärke daher deutlich zu. An der Spitze steht das 2,4,6-Trinitrophenol, es trägt den Trivialnamen Pikrinsäure und besitzt eine Säurestärke in der Größenordnung von Mineralsäuren.
Sicherheitshinweise
Nitrophenole sind giftig beim Einatmen, Verschlucken und Kontakt mit der Haut. Es können Reizungen der Augen, der Verdauungswege, Blutvergiftung, Leberschaden, Schwindel, Übelkeit, Kopfschmerz und Atemwegsreizung auftreten. Möglicherweise wirken sie krebserregend und sensibilisierend. In Verbindung mit Alkohol wird die Wirkung verstärkt. Bei Berührung mit der Haut sollte sofort mit viel Wasser abgewaschen werden. Sie haben giftige Wirkung auf das Nervensystem von Lebewesen.
Nitrophenole fallen in der chemischen, pharmazeutischen und Rüstungsindustrie als Zwischenprodukte bei der Produktion von Farben, Leder, Gummi, Pestiziden, Fungiziden, Schädlingsbekämpfungsmitteln und Munition an.
Ein großes Problem stellt die Entfernung von Nitrophenolen und verwandten Verbindungen aus dem Grundwasser dar. Solche Kontaminationen sind mitunter in ehemaligen Sprengstoff- oder Farbenfabriken und militärischen Anlagen zu finden. Eine neue Entwicklung zur vollständigen Entfernung von Nitrophenolen aus Grundwasser ist ein Katalysator, der aus Eisen mit einem Tetra-Amido-Makrocyclischen Liganden (Fe-TAML) besteht und die Oxidation der Gifte durch Wasserstoffperoxid ermöglicht. Dabei fallen keine weiteren giftigen Substanzen an. Der Katalysator wurde an der Carnegie Mellon University entwickelt.[2]
Nitrophenole
Die Nitrophenole bilden eine Gruppe von Verbindungen mit einer Hydroxygruppe und Nitrogruppe. Es existieren drei verschiedene Konstitutionsisomere.
Nitrophenole Name 2-Nitrophenol 3-Nitrophenol 4-Nitrophenol Andere Namen o-Nitrophenol m-Nitrophenol p-Nitrophenol Strukturformel 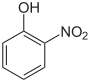
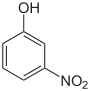

Summenformel: C6H5NO3; Molare Masse: 139,11 g·mol−1 Dinitrophenole
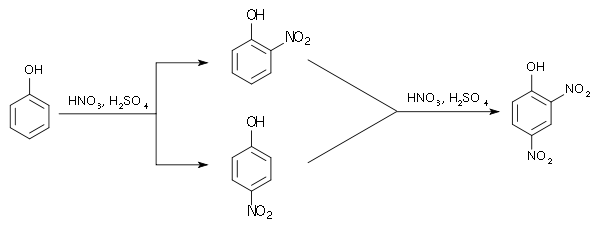
Die Dinitrophenole bilden eine Gruppe von Verbindungen mit einer Hydroxygruppe und zwei Nitrogruppen. Es existieren sechs verschiedene Konstitutionsisomere, von denen das 2,4-Dinitrophenol das wichtigste ist. Letzteres entsteht aus 2- und 4-Nitrophenol durch erneute Nitrierung.
Dinitrophenole Name 2,3-Dinitrophenol 2,4-Dinitrophenol 2,5-Dinitrophenol 2,6-Dinitrophenol 3,4-Dinitrophenol 3,5-Dinitrophenol Strukturformel 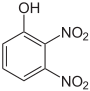

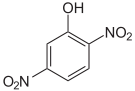
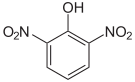
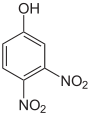
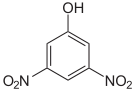
Summenformel: C6H4N2O5; Molare Masse = 184,11 g·mol−1; gelbe, kristalline Feststoffe[3] Trinitrophenole
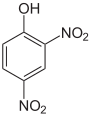
Die Trinitrophenole bilden eine Gruppe von Verbindungen mit einer Hydroxygruppe und drei Nitrogruppen. Es existieren sechs verschiedene Konstitutionsisomere, von denen das 2,4,6-Trinitrophenol (Pikrinsäure) mit Abstand das wichtigste ist.
Pikrinsäure bildet gelbe, stark bitter schmeckende Kristalle. Bedingt durch die Häufung elektronenziehender Nitrogruppen (–NO2) ist die Pikrinsäure durch ihre phenolische Hydroxylgruppe eine starke Säure (pKs = 0,29[1]). Die Pikrinsäure wird über die Sulfonierung von Phenol und nachfolgende Behandlung mit Salpetersäure hergestellt. Die Verwendung von Pikrinsäure als Füllmaterial für Granaten (wie im Ersten Weltkrieg) oder allgemein als Explosivstoff wurde wegen der unkontrollierten Bildung von hochexplosiven Schwermetallpikraten eingestellt. Die Pikrinsäure wurde hier durch TNT ersetzt.
Trinitrophenole Name 2,3,4-Trinitrophenol
2,3,5-Trinitrophenol
2,3,6-Trinitrophenol
2,4,5-Trinitrophenol
2,4,6-Trinitrophenol
(Pikrinsäure)3,4,5-Trinitrophenol
Strukturformel 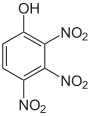
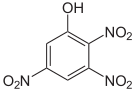
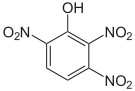
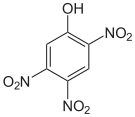

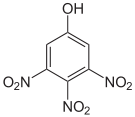
Summenformel: C6H3N3O7; Molare Masse = 229,11 g·mol−1 Tetra- und Pentanitrophenole
Das 2,3,4,6-Tetranitrophenol (C6H2N4O9) ist derart explosiv, dass es nicht transportiert werden darf. Das Pentanitrophenol (C6HN5O11) ist ein Hydrolyseprodukt des Hexanitrobenzols.
Tetra- und Pentanitrophenole Name 2,3,4,5-Tetranitrophenol 2,3,4,6-Tetranitrophenol 2,3,5,6-Tetranitrophenol Pentanitrophenol Strukturformel 
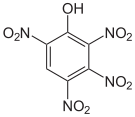
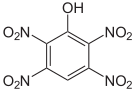
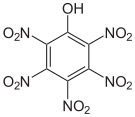
Summenformel C6H2N4O9 C6HN5O11 Molare Masse 274,10 g·mol−1 CAS-Nummer 641-16-7 PubChem 21523193 61190 Einzelnachweise
- ↑ a b CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ WELT online: Katalysator baut Nitrophenol ab (30. August 2005), abgerufen am 25. Februar 2008.
- ↑ Eintrag zu CAS-Nr. 25550-58-7 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 18. März 2008 (JavaScript erforderlich).
Literatur
- Allinger, Cava, de Jongh, Johnson, Lebel, Stevens: Organische Chemie, 1. Auflage, Walter de Gruyter, Berlin 1980, ISBN 3-11-004594-X, S. 375–376, 916.
- Streitwieser/Heathcock: Organische Chemie, 1. Auflage, VCH, Weinheim 1980, ISBN 3-527-25810-8, S. 1056, 1179, 1189–1191.
- Hans Beyer und Wolfgang Walter: Lehrbuch der Organischen Chemie, 19. Auflage, S. Hirzel Verlag, Stuttgart 1981, ISBN 3-7776-0356-2, S. 467–468.
- Morrison/Boyd: Lehrbuch der Organischen Chemie, 3. Auflage, VCH, Weinheim 1986, ISBN 3-527-26067-6, S. 1074–1076, 1121–1122.
Weblinks
Wikimedia Foundation.