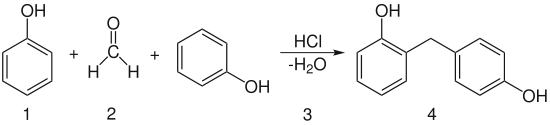
- Phenol
-
Strukturformel 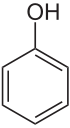
Allgemeines Name Phenol Andere Namen - Carbol
- Hydroxybenzen
- Hydroxy-Cyclohexatrien
- Hydroxybenzol
- Karbolsäure (veraltet)
- Steinkohlenteerkreosot
- Benzolol
- Benzenol
Summenformel C6H6O CAS-Nummer 108-95-2 PubChem 996 ATC-Code Kurzbeschreibung farblose nadelförmige Kristalle mit durchdringendem Geruch[1]
Eigenschaften Molare Masse 94,11 g·mol−1 Aggregatzustand fest
Dichte 1,07 g·cm−3 [1]
Schmelzpunkt Siedepunkt 182 °C[1]
Dampfdruck pKs-Wert 9,99[2]
Löslichkeit mäßig in Wasser (84 g·l−1 bei 20 °C)[1]
Sicherheitshinweise Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [3] 


Gefahr
H- und P-Sätze H: 341-331-311-301-373-314 EUH: keine EUH-Sätze P: 280-302+352-301+330+331-309-310-305+351+338 [1] EU-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [3] 

Giftig Ätzend (T) (C) R- und S-Sätze R: 23/24/25-34-48/20/21/22-68 S: (1/2)-24/25-26-28-36/37/39-45 MAK 7,8 mg·m−3 [1]
LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Das Phenol (IUPAC: Benzenol) ist der einfachste Vertreter der Phenole. Phenole sind organische Verbindungen, in denen mindestens eine Hydroxygruppe direkt an einem aromatischen Ring gebunden ist. Phenol ist ein Derivat des Benzols. Phenol wurde im Jahr 1834 vom Chemiker Friedlieb Ferdinand Runge bei der Destillation von Steinkohlenteer entdeckt; er bezeichnete die Substanz jedoch als "Carbolsäure". Auguste Laurent entdeckte sie 1841 erneut und ermittelte die Summenformel als C6H6O. Charles Gerhardt nannte sie Phenol.[8] Der Name weist auf das Leuchtgas hin, welches neben Steinkohlenteer bei der Produktion von Koks entstand. Leuchtgas (Stadtgas) diente damals zur Beleuchtung der Städte (gr. phainomei: leuchten).
Inhaltsverzeichnis
Darstellung
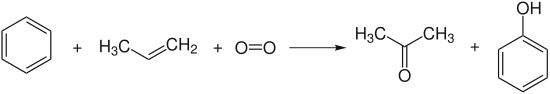
Im industriellen Maßstab wird die Grundchemikalie Phenol durch das Cumolhydroperoxid-Verfahren, auch als Phenolsynthese nach Hock (Hock-Verfahren) bekannt, hergestellt:
Benzol und Propen werden zunächst durch eine Friedel-Crafts-Alkylierung im Sauren in Isopropylbenzol (Cumol) überführt. Cumol wird durch Luftsauerstoff zum Hydroperoxid oxidiert, welches durch saure Aufarbeitung unter Umlagerung zu Phenol und Aceton zerfällt.[9] Das gleichzeitige Entstehen zweier leicht trennbarer, wertvoller Produkte macht dieses Verfahren besonders wirtschaftlich.
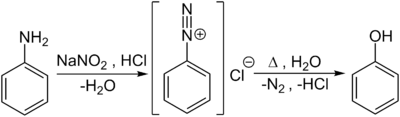
Im Labormaßstab werden Phenole auch durch Verkochen von Diazoniumsalzen, welche durch die Diazotierung von aromatischen Aminoverbindungen – hier von Anilin – mit Salpetriger Säure in der Kälte entstehen, hergestellt:
Eine weitere Darstellungsmöglichkeit besteht im Zusammenschmelzen des Natriumsalzes der Benzolsulfonsäure mit Alkalihydroxid:
Zugänglich sind Phenole ebenfalls über die Synthese eines Acetophenons, nachfolgender Baeyer-Villiger-Oxidation und Hydrolyse des entstehenden Arylacetats.
Eigenschaften
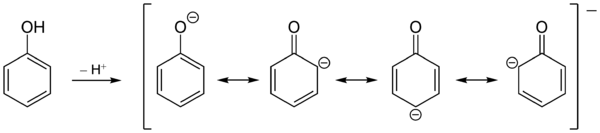
Phenol ist hydroxysubstituiertes Benzol. Sein Schmelzpunkt liegt bei 41 °C und der Siedepunkt bei 182 °C. Reines Phenol bildet bei Zimmertemperatur farblose Kristallnadeln, jedoch ist das kommerziell erhältliche Produkt i. d. R. durch geringe, aber intensiv gefärbte Verunreinigungen rosa bis rötlich-braun gefärbt. Es besitzt einen charakteristischen, aromatischen Geruch. Die Hydroxy-Gruppe des Phenols reagiert im Gegensatz zu Alkoholen sauer, womit Phenol eine schwache Säure ist. Die Ursache ist die Mesomeriestabilisierung der korrespondierenden Base des Phenolations. Die negative Ladung kann in den Ring delokalisiert werden.
Im Gegensatz zu Alkoholen gehen Phenole nur bei hohen Temperaturen und Anwesenheit spezieller Katalysatoren nukleophile Substitutionsreaktionen unter Ersatz der Hydroxy-Gruppe durch andere Nukleophile ein.[10] Die Hydroxy-Funktion zeigt, besonders im deprotonierten Zustand, einen ausgeprägten +M-Effekt. Daneben zeigt sie einen −I-Effekt. Da dieser aber deutlich kleiner ist als der +M-Effekt, wird Phenol sehr leicht elektrophil angegriffen. Der Angriff erfolgt bevorzugt in ortho- und para-Position zur Hydroxy-Gruppe. Wegen des elektronenschiebenden Charakters der Hydroxy-Gruppe ist Phenol etwa tausendmal reaktiver als Benzol.
Die Bevorzugung des ortho- bzw. para-Angriffs von Elektrophilen lässt sich durch Betrachtung der Grenzstrukturen des Phenolat-Anions verstehen. Die negative Ladung wird in den aromatischen Ring auf die ortho- und para-Positionen delokalisiert. Da Elektrophile bevorzugt elektronenreiche Positionen angreifen, kommt es zu der beobachteten Regioselektivität. Die Substitution in para-Position ist zusätzlich bevorzugt, da es dort nicht zu sterischen Wechselwirkungen des angreifenden Elektrophils mit den freien Elektronenpaaren des Sauerstoffs kommt.
Die Keto-Enol-Tautomerie liegt wegen der Ausbildung des thermodynamisch günstigen aromatischen Systems vollständig auf der Enol-Seite.
Eine technisch bedeutende nukleophile Substitutionsreaktion ist die Darstellung von Anilin aus Phenol bei 250 °C und Anwesenheit eines Oxid-Katalysators (Aluminium-, Silicium- oder Magnesiumoxid, auch Borsäure) als „Halcon-Prozess“.[11]
Phenol verursacht Verätzungen und ist ein Nerven-/Zellgift.
Verwendung
Sir Joseph Lister setzte es 1865 zuerst als Antiseptikum bei der Wunddesinfektion ein; wegen seiner hautirritierenden Nebenwirkung wurde es aber in der Chirurgie bald durch andere Antiseptika ersetzt.
Wegen seiner bakteriziden Wirkung wird es noch heute – wenngleich seltener – als Desinfektionsmittel eingesetzt.
Es wird auch als Ausgangsstoff zur Herstellung von Medikamenten, unter anderem von Acetylsalicylsäure, verwendet, als Unkrautvernichtungsmittel und zur Synthese von Kunstharzen. Eines der ersten synthetisch hergestellten Kunstharzprodukte ist Bakelit, ein Polykondensat aus Phenol und Formaldehyd.
Aus Phenol wird Phenolwasser hergestellt, bestehend aus zehn Anteilen Phenol und einem Anteil Wasser. Phenolwasser ist flüssig und erleichtert so die Verwendung. In der Mikroskopie wird Phenolwasser zur Konservierung verwendet, erlaubt aber auch Farbreaktionen.
In der Molekularbiologie war die Extraktion organischen Gewebes mit Mischungen aus Phenol, Chloroform und Isoamylalkohol eines der ersten Verfahren, um hochreine DNA zu gewinnen.
Phenol-Resorcin-Formaldehyd-Kleber werden im konstruktiven Holzbau verwendet.
Während des Zweiten Weltkriegs töteten unter anderem KZ-Ärzte Häftlinge auch durch intrakardiale Phenolinjektionen.
Sicherheitshinweise
Phenol wirkt sowohl lokal als auch systemisch stark toxisch; bei dermaler Exposition besitzt es eine reizende bis ätzende Wirkung auf Schleimhäute, Haut und Augen. Die Augen können Schäden in Form einer Trübung der Hornhaut, Schwellungen und Verwachsung der Lider bis zur Erblindung erleiden. Hautkontakt führt zuerst zu Hautrötung, später zu einer Weißverfärbung; längere Einwirkungszeit verursacht eine Dunkelfärbung bis zur Bildung von Nekrosen.[1]
Phenol wird vorwiegend über die Haut resorbiert, aber auch inhalative oder orale Aufnahme ist möglich. Im menschlichen Organismus schädigt die Substanz akut Nieren, Blut, Zentralnerven- und Herz-Kreislauf-System. Bei chronischer Exposition sind auch gastrointestinale und nervale Störungen, weiterhin Schädigung von Leber, Nieren und Hautveränderungen bekannt. Bei Inhalation wurden als Vergiftungssymptome Schwindel, Kopfschmerz und Störungen der Ohren, Erbrechen, Schlaflosigkeit und Nierenreizung beschrieben. Die Aufnahme hoher Mengen führte innerhalb weniger Stunden zu massiven Nierenfunktionsstörungen bis zu akutem Nierenversagen. Orale Aufnahme bewirkt Verätzungen im Mund, Rachen, Speiseröhre und Magen; weiterhin sind Schluckstörungen und Störungen im Magen-Darm-Trakt bekannt.[1]
Die Toxizität wird auf reaktive Metaboliten des Phenol zurückgeführt, die an die DNA und andere Makromoleküle binden und dabei Brüche in den Chromosomen und mutagene Effekte auslösen können. Eine orale Dosis ab 1 g kann vereinzelt für einen Menschen tödlich sein; individuell wurden aber auch wesentlich höhere Dosen überlebt.[1] Der orale LDLo-Wert für den Menschen liegt zwischen 140[6] und 1400 mg/kg Körpergewicht; bei Kindern beträgt die orale minimale letale Dosis 10 mg/kg Körpergewicht.[5][7]
Historische Beschreibung
„Es handelt sich um eine Substanz, die für die Farbenindustrie und Medizin (als Desinfektionsmittel) eine außerordentliche Bedeutung erlangt hat. Der Handelsname ist immer noch Karbolsäure, während der wissenschaftliche Name jetzt Phenol ist; diese Substanz besitzt zwar die Eigenschaften einer schwachen Säure und ist imstande, sich mit Basen zu verbinden, wird deshalb auch Phenylsäure oder Phensäure genannt, zugleich aber und in noch höherem Grade spielt sie die Rolle eines Alkohols, daher auch der Name Phenylalkohol, den man in Phenol gekürzt hat. Man gewinnt die Karbolsäure hauptsächlich aus dem Steinkohlenteer und dem Braunkohlenteer, im Holzteer sind nur äußerst geringe Mengen davon enthalten, denn das Kreosot des Holzteers besteht nicht, wie man eine Zeit lang glaubte, aus Phenol, sondern aus dem strukturell ähnlichen Kresol, sowie noch einigen anderen Stoffen. Um die Karbolsäure zu gewinnen, behandelt man den zwischen 150–200 °C übergehenden Teil des Teers mit Natronlauge, welche sich mit der Karbolsäure und dem Kresol, das auch im Steinkohlenteer enthalten ist, verbindet, trennt diese Lösung von den übrigen Teerbestandteilen und zersetzt sie mit einer Säure. Man destilliert dann das abgeschiedene ölige Produkt und fängt das, was über 190 °C übergeht, besonders auf; letzteres wird als rohes Kresol, das, was unter 190 °C übergeht, als rohe Karbolsäure verkauft. Beide Substanzen sind in diesem Zustande noch braune, sehr übel riechende, ölige Flüssigkeiten. Diese rohe Karbolsäure (acidum carbolicum crudum) wird teils weiter gereinigt, teils wird sie zur Konservierung von Holz und zum Desinfizieren von Abtrittgruben verwendet.“[12]
Weblinks
- Phenol auf seilnacht.com
- Produktionsstandort vom Phenol auf der Route der Industriekultur
Einzelnachweise
- ↑ a b c d e f g h i j k Eintrag zu CAS-Nr. 108-95-2 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 28. März 2008 (JavaScript erforderlich).
- ↑ CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ a b Eintrag zu CAS-Nr. 108-95-2 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ NOAA Material Safety Data Sheet.
- ↑ a b c W. B. Deichmann: Toxicology of Drugs and Chemicals. New York 1969, Academic Press, S. 463.
- ↑ a b R. Lefaux, O. H. Cleveland: Practical Toxicology of Plastics. Chemical Rubber Co., 1968, S. 329, 1968.
- ↑ a b Phenol bei ChemIDplus.
- ↑ Max Bloch, in Günther Bugge, Das Buch der großen Chemiker, Band 2, S. 92-114, Verlag Chemie, Berlin, 1930.
- ↑ Römpp CD 2006, Georg Thieme, 2006
- ↑ S. A. Lawrence: Amines: synthesis, properties and applications. S. 80, Cambridge University Press, 2004, ISBN 978-0-521-78284-5
- ↑ H.-J. Arpe, K. Weissermel: Industrielle Organische Chemie: Bedeutende Vor- und Zwischenprodukte. 6. Auflage, S. 418, Wiley-VCH, 2007, ISBN 978-3-527-31540-6
- ↑ Karbolsäure. In: Merck’s Warenlexikon, 3. Auflage, G. A. Gloeckner, Leipzig 1884, S. 250–251
Kategorien:- ATC-C05
- ATC-D08
- ATC-N01
- ATC-R02
- Giftiger Stoff
- Ätzender Stoff
- Gesundheitsschädlicher Stoff
- Phenol
- Arzneistoff
- Pharmazeutischer Hilfsstoff
Wikimedia Foundation.

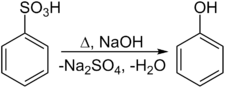
![\mathrm{C_6H_5OH \ + \ NH_3 \ \xrightarrow[Kat.]{250^{\circ}C} \ C_6H_5NH_2 \ + \ H_2O}](e/87e081eea6830d96fd849d4e54b41fd6.png)