- 2,3,3,3-Tetrafluorpropen
-
Strukturformel 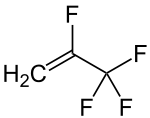
Allgemeines Name 2,3,3,3-Tetrafluorpropen Andere Namen - HFO-1234yf
- R1234yf
- 2,3,3,3-Tetrafluorpropylen
Summenformel C3H2F4 CAS-Nummer 754-12-1 PubChem 2776731 Kurzbeschreibung Farbloses Gas[1]
Eigenschaften Molare Masse 114 g·mol−1 Aggregatzustand gasförmig
Dichte 1,1 g·cm−3 bei 25 °C (flüssig)[1]
Schmelzpunkt Siedepunkt −30 °C[1]
Dampfdruck Löslichkeit sehr schlecht in Wasser (198,2 mg·l−1 bei 24 °C)[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [2] 

Gefahr
H- und P-Sätze H: 220-280 EUH: keine EUH-Sätze P: 281-210-260-308+313-410+403 [2] EU-Gefahrstoffkennzeichnung [1] 
Hoch-
entzündlich(F+) R- und S-Sätze R: 12 S: 9-16 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. 2,3,3,3-Tetrafluorpropen oder HFO-1234yf (Handelsname: R-1234yf) ist eine chemische Verbindung aus der Stoffgruppe der Alkene und organischen Fluorverbindungen.
Inhaltsverzeichnis
Gewinnung und Darstellung
Eine Darstellung der Verbindung ist in mehreren Stufen, ausgehend von 1,2,3-Trichlorpropan, möglich. Dabei wird zunächst über Eliminierung und anschließende Addition das mittlere Fluoratom eingeführt. Nach Bildung eines Tetrachlor-Fluorpropans durch Chlorierung im Sonnenlicht wird die Verbindung teilweise fluoriert. In den letzten Schritten wird zunächst durch Dehydrohalogenierung 3-Chlor-2,3,3-trifluorpropen und 3,3-Dichlor-2,3-difluorpropen dargestellt, die mit Antimonpentafluorid zu 2,3,3,3-Tetrafluorpropen umgesetzt werden.[3]
Eigenschaften
2,3,3,3-Tetrafluorpropen ist ein brennbares, farbloses Gas mit schwachem Eigengeruch. Im Gegensatz zu chlorhaltigen Kohlenwasserstoffen ist es nicht ozonabbauend und schädigt damit nicht die Ozonschicht. Auch sein Treibhauspotential ist gering und beträgt 4,4 (bezogen auf 100 Jahre, Kohlenstoffdioxid = 1). Es steht damit im Gegensatz zu anderen Fluorkohlenwasserstoffen wie Tetrafluorethan mit einem Treibhauspotential von 1430. Der Grund hierfür liegt im schnellen Abbau von 2,3,3,3-Tetrafluorpropen, seine mittlere Lebenszeit in der Atmosphäre beträgt nur etwa 12 Tage. Es reagiert dabei vor allem mit den reaktiven Hydroxy-Radikalen in der Atmosphäre, wobei es sich zunächst zu Trifluoracetylfluorid und durch Hydrolyse schließlich zur stabilen Trifluoressigsäure abbaut.[4][5]
Verwendung
2,3,3,3-Tetrafluorpropen soll als Ersatzstoff für Tetrafluorethan als Kältemittel in den Klimaanlagen aller Autotypen verwendet werden, die in Zukunft auf den Markt kommen[6].
Sicherheitshinweise
2,3,3,3-Tetrafluorpropen bildet brennbare Gas-Luft-Gemische und wird als hochentzündlich eingestuft. Der Explosionsbereich liegt zwischen 6,2 Vol% als untere Explosionsgrenze (UEG) und 12,3 Vol% als obere Explosionsgrenze (OEG).[1] Eine zweite Quelle gibt einen Bereich von 6,7 Vol % bis 11,7 Vol % an.[7] Die Selbstentzündungstemperatur liegt zwischen 400 °C[8]) und 405 °C.[1] Bei der Verbrennung wird giftiger und ätzender Fluorwasserstoff frei.[1]
Sonstiges
Der Berufsverband Feuerwehr will wegen der mit diesem Stoff verbundenen Gefahren ein Verwendungsverbot[9].
Einzelnachweise
- ↑ a b c d e f g h i j k MSDS 2,3,3,3-Tetrafluorpropen in Deutsch (Honeywell)
- ↑ a b Eintrag zu 2,3,3,3-Tetrafluorpropen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 15. August 2011 (JavaScript erforderlich)
- ↑ Albert L. Henne, T. Phillip Waalkes: Fluorinated Derivatives of Propane and Propylene. VI. In: J. Am. Chem. Soc. 1946, 68, 3, S. 496–497, doi:10.1021/ja01207a041.
- ↑ O.J. Nielsen, M.S. Javadi, M.P. Sulbaek Andersen, M.D.Hurley, T.J. Wallington, R. Singh: Atmospheric chemistry of CF3CFCH2: Kinetics and mechanisms of gas-phase reactions with Cl atoms, OH radicals, and O3. In: Chemical Physics Letters. 2007, 439, 1-3, S. 18–22, doi:10.1016/j.cplett.2007.03.053.
- ↑ Vassileios C. Papadimitriou, Ranajit K. Talukdar, R. W. Portmann, A. R. Ravishankara, James B. Burkholder: CF3CF=CH2 and (Z)-CF3CF=CHF: temperature dependent OH rate coefficients and global warming potentials. In: Phys. Chem. Chem. Phys. 2008, 10, S. 808-820, doi:10.1039/b714382f.
- ↑ ARD-Magazin Monitor:„Irreversible Schäden“: Behörden warnen vor Gefahren durch neues Auto-Kältemittel 15. September 2011
- ↑ Shigeo Kondo, Kenji Takizawa, Akifumi Takahashi, Kazuaki Tokuhashi, Junji Mizukado, Akira Sekiya: Flammability limits of olefinic and saturated fluoro-compounds in J. Hazard. Mat. 171 (2009) 613–618, doi:10.1016/j.jhazmat.2009.06.042.
- ↑ Martin Graz, Uwe Wuitz; Flammability Investigation of Different Refrigerants using an operating MAC system in a simulated front end collision situation.
- ↑ http://www.bv-feuerwehr.eu/presseerkl%C3%A4rungen/237-pressemitteilung-27092011.html
Wikimedia Foundation.
