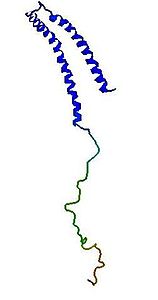
- α-Synuclein
-
Α-Synuclein Vorhandene Strukturdaten: 1XQ8 Masse/Länge Primärstruktur 140 Aminosäuren Sekundär- bis Quartärstruktur Monomer Isoformen 3 Bezeichner Gen-Name SNCA Externe IDs OMIM: 163890 UniProt: P37840 Transporter-Klassifikation TCDB 1.C.77.1.1 Bezeichnung Synuclein-Familie Vorkommen Übergeordnetes Taxon Wirbeltiere[1] α-Synuclein (auch α-Synuklein) ist ein kleines, lösliches Protein im Gehirn von Wirbeltieren, das unter anderem die Dopamin-Ausschüttung reguliert. Es ist in der Lage, Membrankanäle zu bilden und ist daher ein Transportprotein. Mutationen im SNCA-Gen sind verantwortlich für die erblichen Formen 1 und 4 der Parkinson-Krankheit und der Lewy-Körperchen-Demenz.[2][3][4][5]
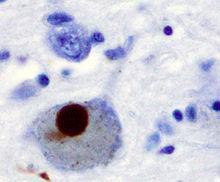
Es wurde im menschlichen Gehirn als Vorstufe des nicht-Amyloid β-Proteins identifiziert. Wissenschaftler des US-amerikanischen National Human Genome Research Institute (NHGRI) an den National Institutes of Health (NIH) in Bethesda, Maryland haben 1997 herausgefunden, dass es an mehreren pathogenen Prozessen bei neurodegenerativen Erkrankungen wie zum Beispiel dem Morbus Parkinson beteiligt ist. So wurde in den für letztere typischen Lewy-Körperchen eine positive Immunreaktion für Antikörper gegen α-Synuclein gefunden.[6] Diesem Protein wird eine toxische Wirkung auf bestimmte Nervenzellen, vor allem aber auf dopaminerge Neurone der Substantia nigra zugeschrieben, in denen es in Form von Protofibrillen als Mitverursacher oxidativen Stresses und daraus resultierenden neuronalen Zelltodes angesehen wird.[7] Es wird auch eine Bedeutung der α-Synucleine bei der Entstehung von Prionkrankheiten oder der Alzheimerschen Krankheit diskutiert.
Die Gruppe neurodegenerativer Erkrankungen, bei denen es zu einer pathologischen Akkumulation von α-Synuclein im zentralen Nervensystem kommt, bezeichnet man als Synucleinopathien.
Quellen
- ↑ Homologe zu P37840 bei OMA
- ↑ George JM: The synucleins. In: Genome Biol.. 3, Nr. 1, 2002, S. REVIEWS3002. PMID 11806835. Volltext bei PMC: 150459.
- ↑ Lavedan C: The synuclein family. In: Genome Res.. 8, Nr. 9, September 1998, S. 871–80. doi:10.1101/gr.8.9.871. PMID 9750188.
- ↑ UniProt P37840
- ↑ Pathway DB: Alpha-synuclein signaling
- ↑ Brunn, A.: Vorlesung Allgemeine Pathologie. Abteilung für Neuropathologie, Universität zu Köln, Sommersemester 2005. PDF
- ↑ Tolnay, M. (2000): α-Synuclein und Tau: abnorme Proteinablagerungen beim Parkinson-(plus)-Syndrom. In: Schweiz. Arch. Neurol. Psychiatr. Bd. 151, S. 136-145. PDF
Literatur
- Polymeropoulos MH, Lavedan C, Leroy E, et al.: Mutation in the alpha-synuclein gene identified in families with Parkinson's disease. In: Science. 276, Nr. 5321, Juni 1997, S. 2045–7. doi:10.1126/science.276.5321.2045. PMID 9197268.
- Neumann M, Kahle PJ, Giasson BI, et al.: Misfolded proteinase K-resistant hyperphosphorylated alpha-synuclein in aged transgenic mice with locomotor deterioration and in human alpha-synucleinopathies. In: J. Clin. Invest.. 110, Nr. 10, November 2002, S. 1429–39. doi:10.1172/JCI15777. PMID 12438441. Volltext bei PMC: 151810.
- Sandra Blakeslee: In Folding Proteins, Clues to Many Diseases. In: The New York Times, 21. Mai 2002
- Jowaed A, Schmitt I, Kaut O, Wüllner U: Methylation regulates alpha-synuclein expression and is decreased in Parkinson's disease patients' brains. In: J. Neurosci.. 30, Nr. 18, Mai 2010, S. 6355–9. doi:10.1523/JNEUROSCI.6119-09.2010. PMID 20445061.
Weblinks
Wikimedia Foundation.