- Aufbauprinzip
-
Das Aufbauprinzip des Periodensystems wird verwendet, um die Anordnung der Elektronen in Atomen, Molekülen oder Ionen zu ermitteln. Dem Prinzip liegt ein hypothetischer Prozess zu Grunde, der das Auffüllen der Hüllen mit Elektronen beschreibt. Jedes neu hinzugefügte Elektron versucht, in einen für sich stabilsten Zustand zu gelangen. Sowohl durch die Anzahl der Protonen und Neutronen im Kern, als auch durch die sich bereits in der Hülle befindlichen Elektronen, wird das Elektron in einem fest definierten Orbital seinen Platz finden.
Nach dem Prinzip füllen die Elektronen die Orbitale immer dort auf, wo der geringste Energiezustand erreicht werden kann, bevor sie höhere Energiezustände annehmen (z.B. 1s immer vor 2s). Die maximale Elektronenanzahl in jedem Orbital ist durch das Pauli-Prinzip begrenzt. Wenn für ein Elektron mehrere Orbitale mit dem gleichen Energiezustand zur Auswahl stehen, wird laut den hundschen Regeln immer das noch nicht voll besetzte Orbital gewählt.
Das Aufbauprinzip kann auch herangezogen werden, um die Anordnung von Protonen und Neutronen in einem Atomkern zu beschreiben.
Inhaltsverzeichnis
Das Madelung-Energieschema
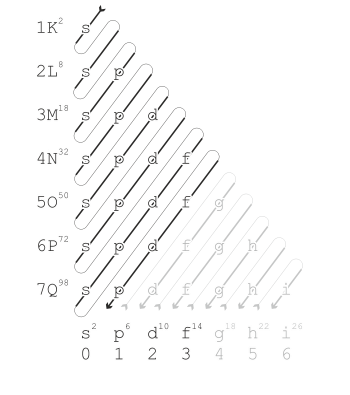 In dieser Reihenfolge besetzen die Elektronen die Orbitale der Atomhülle. Der Pfeil spiegelt die Reihenfolge der hinzugefügten Elektronen wider. Von links nach rechts sind die Orbitale der Atomhülle aufgezählt, von oben nach unten die Schalen der Atomhülle. Die hochgestellten Zahlen geben an, wie viele Elektronen sich jeweils im Orbit oder in der Schale maximal aufhalten können.
In dieser Reihenfolge besetzen die Elektronen die Orbitale der Atomhülle. Der Pfeil spiegelt die Reihenfolge der hinzugefügten Elektronen wider. Von links nach rechts sind die Orbitale der Atomhülle aufgezählt, von oben nach unten die Schalen der Atomhülle. Die hochgestellten Zahlen geben an, wie viele Elektronen sich jeweils im Orbit oder in der Schale maximal aufhalten können.
Die Reihenfolge, nach der die Elektronen die Orbitale besetzen wird durch die n+l-Regel beschrieben (auch bekannt als die Madelung-Regel nach Erwin Madelung oder die Klechkowski-Regel in manchen, meist französisch sprechenden Ländern). Orbitale mit einem kleineren n+l-Wert werden vor den Orbitalen mit einem größeren Wert gefüllt. Die Regel basiert auf der Gesamtanzahl der Knoten in einem Orbital, was den Energiezustand widerspiegelt.[1] Falls die n+l-Werte gleich sind, wird das Orbital mit dem kleineren n-Wert zuerst gefüllt. Dieses Verhalten der Elektronen wurde experimentell durch die spektroskopischen Eigenschaften der Elemente herausgefunden.[2]
Der Reihe nach werden die Elektronen in folgende Orbitale eingegliedert: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
Hinweis: Das Madelung-Energieschema kann nur auf neutrale Atome in ihrem Grundzustand angewendet werden. (Siehe Ausnahmen)
Ausnahmen
Nicht bei allen Atomkernen halten sich die Elektronen an die mathematisch definierte Regel. Bekannte Beispiele von Elementen, die sich anders verhalten sind:[3][4]
- Bei Lanthan besetzt zuerst ein Elektron ein Orbital der 5d-Unterschale bevor 4f aufgefüllt wird, bei Actinium besetzt entsprechend ein Elektron 6d bevor 5f aufgefüllt wird. Die Elektronen besetzen zuerst leere Orbitale innerhalb einer Unterschale.
- Bei Kupfer und Chrom wechselt ein Elektron des 4s Orbitals in das 3d Orbital, sodass das 4s Orbital trotz seines niedrigeren Energieniveaus nur einfach besetzt ist. Allerdings sind so die 3d-Orbitale halb (Chrom) bzw. vollständig (Kupfer) besetzt.
- Weitere Ausnahmen sind: Niob, Molybdän, Technetium, Ruthenium, Rhodium, Palladium, Silber, Iridium, Platin, Gold, Gadolinium und einige Actinoide: Actinium bis Neptunium und Curium.
Siehe auch
Einzelnachweise
- ↑ Frank Weinhold, Clark R. Landis: Valency and bonding: A Natural Bond Orbital Donor-Acceptor Perspective. Cambridge University Press, Cambridge 2005, ISBN 0-521-83128-8, S. 715–716.
- ↑ Eric R. Scerri: How Good Is the Quantum Mechanical Explanation of the Periodic System?. In: Journal of Chemical Education. 75, Nr. 11, 1998, S. 1384–85. doi:10.1021/ed075p1384.
- ↑ Erwin Riedel: Anorganische Chemie. 2. Auflage. 1990, ISBN 3-11-012321-5. (für die Ausnahmen der Regel für die Besetzung der Atomorbitale)
- ↑ Terry L. Meek, Leland C. Allen,: Configuration irregularities: deviations from the Madelung rule and inversion of orbital energy levels. In: Chemical Physics Letters. 362, Nr. 5-6, 2002, S. 362–364. doi:10.1016/S0009-2614(02)00919-3.
Wikimedia Foundation.
