- Bispidin
-
Strukturformel 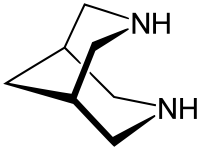
Allgemeines Name Bispidin Andere Namen 3,7-Diazabicyclo[3.3.1]nonan
Summenformel C7H14N2 CAS-Nummer 280-74-0 PubChem 192720 Eigenschaften Molare Masse 126,20 g·mol−1 Schmelzpunkt 158-161 °C[1]
Siedepunkt 190-195 °C (9 Torr)[2]
Sicherheitshinweise EU-Gefahrstoffkennzeichnung [3] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Bispidin ist eine bicyclische, heterocyclische Verbindung, deren systematischer Name 3,7-Diazabicyclo[3.3.1]nonan lautet.
Inhaltsverzeichnis
Vorkommen
Bispidin bildet den Grundkörper einiger Alkaloide wie z.B. Spartein[4] und Cytisin[5].
Darstellung
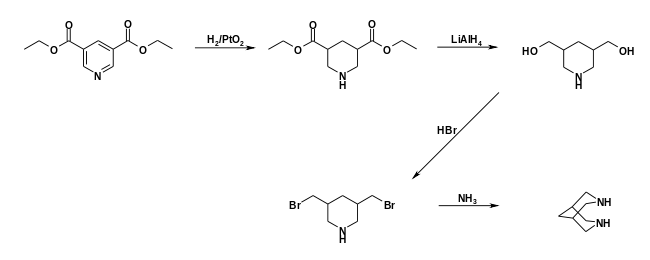
Die Synthese von Bispidin kann über eine durch Raney-Nickel katalysierte Hydrierung von Pyridin-3,5-carbonitril erfolgen.[6] Eine mehrstufige Synthese geht vom Pyridin-3,5-dicarboxyethylester aus, der zunächst über Platinoxid zum Piperidin-3,5-dicarboxyethylester hydriert wird. Eine Reduktion mittels Lithiumaluminiumhydrid ergibt dann 3,5-Bis(hydroxymethyl)-piperidin. Durch nucleophile Substitution wird der Dialkohol zunächst in das Dibromid und dann in das Diamid überführt, welches zur Zielverbindung zyklisiert.[7]
Eine neuere Synthese geht von Allylamin und Ethylacrylat aus, wo zunächst in einer doppelten Mannich-Reaktion über 1-Allylpiperidin-4-on das N,N'-Diallylbispidinon gebildet wird. Eine anschließende Wolff-Kishner-Reduktion und Deallylierung mit Chlorameisensäureethylester ergibt das Bispidin.[1]
Bispidinderivate können zum Beispiel durch selektive Michael-Additionen dargestellt werden.[8][9][10]
Eigenschaften
Bispidin ist ein weißer kristalliner Feststoff, der schon ab 135 °C zu sublimieren beginnt.[11] Im geschlossenen Röhrchen kann ein Schmelzpunkt bei 158-161 °C beobachtet werden.[1]
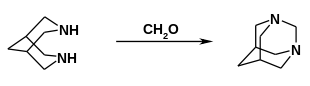
Die Umsetzung mit Formaldehyd ergibt das Diazaadamantan.[7]
Verwendung
Bispidinderivate finden Anwendung in der Chemie als Chelatliganden[12] für Übergangsmetalle.
Einzelnachweise
- ↑ a b c Y. Miyahara, K. Goto, T. Inazu: Convenient Synthesis of 3,7-Diazabicyclo[3.3.1]nonane (Bispidine) in Synthesis 2001, 364–366, doi:10.1055/s-2001-11427.
- ↑ H. Stetter, R. Merten: Über Verbindungen mit Urotropin-Struktur, IX. Zur Kenntnis des Bispidins in Chem. Ber. 90 (1957) 868–875, doi:10.1002/cber.19570900605
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ D. Hoppe, T. Hense: Enantioselektive Synthese mit Lithium/(−)-Spartein-Carbanion-Paaren in Angew. Chem. 109 (1997) 2376–2410, doi:10.1002/ange.19971092105.
- ↑ D. Stead, P. O'Brien, A.J. Sanderson: Concise Synthesis of (±)-Cytisine via Lithiation of N-Boc-bispidine in Org. Lett. 7 (2005) 4459–4462, doi:10.1021/ol0516869.
- ↑ F. Bohlmann, N. Ottawa, R. Keller: Aufbau des Tetrahydro-chinolizons und des „Bispidins” Beiträge zur Synthese des Cytisins in Liebigs Ann. Chem. 587 (1954) 162–176, doi:10.1002/jlac.19545870210.
- ↑ a b F. Galinovsky, H. Langer: Synthese des 1,3-Diaza-adamantans und des Bispidins in Monatshefte für Chemie 86 (1955) 449–453, doi:10.1007/BF00903631.
- ↑ M. Breuning, M. Steiner: Convenient Multigram Synthesis of (R)-Homopipecolic Acid Methyl Ester in Synthesis 2006, 1386–1389, doi:10.1055/s-2006-926419.
- ↑ M. Breuning, D. Hein: First asymmetric synthesis of a C2-symmetric 2-endo,6-endo-disubstituted bispidine in Tetrahedron Asym. 18 (2007) 1410–1418, doi:10.1016/j.tetasy.2007.06.010.
- ↑ Uni-Würzburg: Chirale Bispidine und 9-Oxabispidine
- ↑ F. Galinovsky, F. Sparatore, H. Langer: Eine neue Synthese des Tetrahydro-desoxy-cytisins. Zur Kenntnis des Bispidins in Monatshefte für Chemie 87 (1956) 100–105, doi:10.1007/BF00903593
- ↑ P. Comba, M. Maurer, P. Vadivelu: Oxidation of Cyclohexane by High-Valent Iron Bispidine Complexes: Tetradentate versus Pentadentate Ligands in Inorg. Chem. 48 (2009) 10389–10396, doi:10.1021/ic901702s.
Wikimedia Foundation.