- Leukopterin
-
Strukturformel 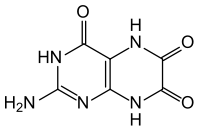
Allgemeines Name Leukopterin Andere Namen - Leucopterin;
- 2-Amino-5,8-dihydro-4,6,7(1H)-pteridintrion
- 2-Amino-4,6,7-pteridintriol
- 2-Amino-4,6,7-trihydroxypteridin
Summenformel C6H5N5O3 CAS-Nummer 492-11-5 PubChem 10291 Kurzbeschreibung Fast farblose Kristalle
Eigenschaften Molare Masse 195,14 g·mol−1 Aggregatzustand fest
Löslichkeit Schwerlöslich in Wasser: ca. 1,25 g·l−1 (20 °C)[1]
Sicherheitshinweise EU-Gefahrstoffkennzeichnung [2] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Leukopterin ist eine chemische Verbindung aus der Gruppe der Pteridine.
Inhaltsverzeichnis
Vorkommen
Aus den Flügeln von Weißlingen der Arten Pieris brassicae und Pieris napi wurde 1926 von Clemens Schöpf und Heinrich Otto Wieland eine Substanz isoliert, welche die weiße Farbe der Schmetterlingsflügel verursacht.[3] Dieses Flügelpigment wurde „Leukopterin“ genannt (von griechisch leukos, ‚weiß‘ und pteron, ‚Flügel‘).[4]
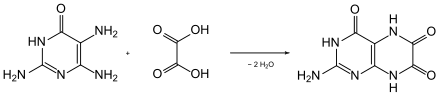
Zum Beweis der Struktur synthetisierte Robert Purrmann 1940 die Verbindung, indem er 2,4,5-Triamino-1,6-dihydropyrimidin-6-on (2,4,5-Triamino-6-hydroxypyrimidin) mit einem Überschuss von Oxalsäure unter Erhitzen verschmolz.[5][6]
Eigenschaften
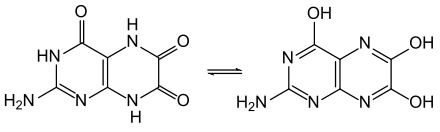
Wie Pterin hat auch Leukopterin die Möglichkeit der Keto-Enol-Tautomerie, hier besser Lactam-Lactim-Tautomerie: 2-Amino-5,8-dihydro-4,6,7(1H)-pteridintrion versus 2-Amino-4,6,7-pteridintriol. Weitere Tautomere sind denkbar. Der Vergleich des UV-Spektrums in Lösung mit denen anderer substituierter Pteridine deutet darauf hin, dass die in der Infobox gezeigte Lactamstruktur vorliegt.[7]
Leukopterin ist eine schwache Säure und löst sich daher in Alkalien, z.B. Sodalösung oder verdünnter Natronlauge. Auf Zugabe von 2n-Salzsäure fällt der farblose Feststoff wieder aus, was Schöpf und Purrmann zur Reinigung der Substanz nutzten. Die Acidität ist am höchsten für die N(8)-H-Gruppe, gefolgt von N(3)-H und am Ende N(5)-H. Von der Verbindung wurden Natrium-, Barium- und Ammoniumsalze hergestellt. Leukopterin bildet fast farblose Kristalle, die 0,5 Moläquivalente Kristallwasser enthalten (Hemihydrat).
Biosynthese
Eine radiochemische Studie an Raupen und Puppen des Kohlweißlings (Pieris brassicae L.) mit 14C-markierten Substanzen kam zu dem Schluss, dass Leukopterin im Schmetterling aus dem Purin-Derivat Guanin bzw. Guanosin hervorgeht, wobei wahrscheinlich Xanthopterin der unmittelbare Vorläufer ist. Die Oxo-Gruppe an C-8 kann durch das Enzym Xanthin-Oxidase eingeführt werden.[8]
Literatur
- Robert Purrmann, Pterine, Fortschritte der Chemie Organischer Naturstoffe 4, 64-86 (1945). Diese frühe Übersicht schildert die historische Entwicklung der Erkenntnisse über Leukopterin und anderer Pterin-Derivate.
Einzelnachweise
- ↑ Beilsteins Handbuch der Organischen Chemie, 4. Ergänzungswerk, Bd. 26, S. 4017.
- ↑ Sequoia Research: MSDS
- ↑ Clemens Schöpf, Heinrich Wieland: Über das Leukopterin, das weiße Flügelpigment der Kohlweißlinge (Pieris brassicae und P.napi). In: Berichte der deutschen chemischen Gesellschaft, 59, 2067–2072 (1926), doi:10.1002/cber.19260590865.
- ↑ Clemens Schöpf, Rolf Reichert: Zur Kenntnis des Leukopterins, Justus Liebigs Annalen der Chemie, 548, 82-94 (1941), doi:10.1002/jlac.19415480108.
- ↑ Robert Purrmann: Über die Flügelpigmente der Schmetterlinge. VII. Synthese des Leukopterins und Natur des Guanopterins. Justus Liebigs Annalen der Chemie, 544, 182–190 (1940), doi:10.1002/jlac.19405440111.
- ↑ Robert Purrmann: Konstitution und Synthese des sogenannten Anhydroleukopterins. Über die Flügelpigmente der Schmetterlinge XII. Justus Liebigs Annalen der Chemie, 548, 284–292 (1941); doi:10.1002/jlac.19415480121.
- ↑ Wolfgang Pfleiderer, Manfred Ruckwied, Zur Struktur des Leukopterins, Chem. Ber. 94, 118-124 (1961).
- ↑ Friedrich Weygand, H. Simon, G. Dahms, M. Waldschmidt, H. J. Schliep, H. Wacker, Über die Biogenese des Leucopterins. Angewandte Chemie, 73, 402–407(1961). doi:10.1002/ange.19610731111
Wikimedia Foundation.