- Trinitromethan
-
Strukturformel 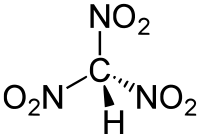
Allgemeines Name Trinitromethan Andere Namen Nitroform
Summenformel CHN3O6 CAS-Nummer 517-25-9 PubChem 10602 Kurzbeschreibung farbloser Feststoff (unterhalb des Schmelzpunktes)[1]
Eigenschaften Molare Masse 151,04 g·mol−1 Aggregatzustand fest
Dichte 1,806 g·cm-1[2]
Schmelzpunkt 25,35 °C[2]
Löslichkeit gut löslich in Wasser[1]
Sicherheitshinweise EU-Gefahrstoffkennzeichnung [3] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Trinitromethan ist ein instabiles ungesättigtes Nitroderivat des Methans und damit ein Nitroalkan. Die Verbindung ist der dreifachsubstituierte Vertreter der Reihe der Nitromethane mit Nitromethan, Dinitromethan, Trinitromethan und Tetranitromethan.
Inhaltsverzeichnis
Gewinnung und Darstellung
Trinitromethan wurde zuerst 1857 in Form seines Ammoniumsalzes durch Schischkow hergestellt. Im Jahr 1918 wurde eine Synthese durch die kombinierte Oxydation und Nitrierung von Ethin mit Salpetersäure entwickelt[4][5], die eine industrielle Herstellung erlaubt.[6] Hierbei werden die beiden Reaktanten in einem Rohrreaktor im Gegenstromprinzip umgesetzt.[6] Im Labor kann es ebenfalls durch Hydrolyse von Tetranitromethan unter milden basischen Bedingungen gewonnen werden.[7] Auch die Herstellung durch Reaktion von Salpetersäure mit Isopropylalkohol ist möglich.[8] Das Ammoniumsalz entsteht bei der Einwirkung von Wasser oder Alkohol auf Trinitroacetonitril.[9]
Eigenschaften
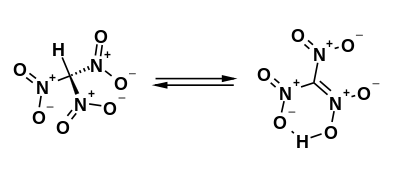
Trinitromethan ist eine starke Säure[10]. Die farblose freie Säure ist instabil, das intensiv gelbe Anion (NO2)3C− in wässriger Lösung stabil.[11] Für Trinitromethan können zwei tautomere Strukturen formuliert werden. Das Gleichgewicht liegt fast vollständig auf der Seite der C-H-aciden Struktur. Quantenchemische Berechnungen ergeben eine Differenz der freien Enthalpie von 33,0 kJ·mol-1 zur N-OH-aciden Struktur.[12] Das 1H-NMR-Spektrum zeigt nur ein einziges Signal bei 2,48 ppm für die C-H-Funktion.[13] In der Reihe der Nitromethane ist dies die größte Verschiebung gegenüber Methan mit 9,767 ppm, Nitromethan mit 5,72 ppm und Dinitromethan mit 3,90 ppm.[13]
Verwendung
Trinitromethan wird zur Herstellung von Sprengstoffen und Treibstoffen verwendet.[8]
Sicherheitshinweise
Trinitromethan explodiert bei raschem Erhitzen heftig.[9] Auch Lösungen mit einem Wassergehalt von weniger als 55 Ma% können sich noch explosiv zersetzen.[6]
Einzelnachweise
- ↑ a b Trinitromethane (Chemyq)
- ↑ a b Schoedel, H.; Dienelt, R.; Bock, H.: Acta Cryst. C: Cryst. Struct. Comm. 50 (1994) 1790–1792, doi:10.1107/S0108270194002131.
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ K.J.P. Orton: B.P. 125.000 (1918)
- ↑ K.J.P. Orton, P.V. McKie: in J. Chem. Soc. 117 (1920) 283–297.
- ↑ a b c A. Wetterholm: Produktion of trinitromethane on an industrial scale in Tetrahedron 19 Suppl. 1 (1963) 155–163.
- ↑ Gakh, A. A.; Bryan, J. C.; Burnett, M. N.; Bonnesen, P. V. (2000), "Synthesis and structural analysis of some trinitromethanide salts", J. Mol. Struct. 520 (1-3): 221–28, doi:10.1016/S0022-2860(99)00333-6.
- ↑ a b Production of trinitromethane.
- ↑ a b Richard Escales; Nitrosprengstoffe, S.200, ISBN 978-3-8330-0114-7.
- ↑ Shechter, H.; Cates Jr., H.L.: Addition Reactions of Trinitromethane and a,ß-Unsaturated Ethers in J. Org. Chem. 26 (1961) 51–53, doi:10.1021/jo01060a010.
- ↑ Novikov, S. S.; Slovetskii, V. I.; Shevelev, S. A.; Fainzilberg, A. A.: Spectrophotometric Determination of the Dissociation Constants of Aliphatic Nitro Compounds in Russ. Chem. Bull. 11 (1962) 552–59,doi:10.1007/BF00904751.
- ↑ H. Brand, J.F. Liebman, A. Schulz: Cyano-, Nitro- and Nitrosomethane Derivatives: Structures and Gas-Phase Acidities in Eur. J. Org. Chem. 2008, 4665–4675, doi:10.1002/ejoc.200800583.
- ↑ a b W. Hofmann, L. Stefaniak, T. Urbanski, M. Witanowski: Proton Magnetic Resonance Study of Nitroalkanes in J. Am. Chem. Soc. 86 (1964) 554–558, doi:10.1021/ja01058a005.
Wikimedia Foundation.