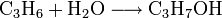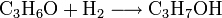- Isopropylalkohol
-
Strukturformel 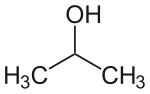
Allgemeines Name 2-Propanol Andere Namen - Propan-2-ol (IUPAC)
- Propanol-2
- Isopropanol
- Isopropylalkohol (IPA)
- sekundärer Propylalkohol
- sek-Propanol
- Persprit
- Petrohol
- Petrosol
- Dimethylcarbinol
- β-Hydroxypropan
- Propol
Summenformel C3H8O CAS-Nummer 67-63-0 PubChem 3776 Kurzbeschreibung farblose Flüssigkeit mit alkoholartigem Geruch [1] Eigenschaften Molare Masse 60,10 g·mol−1 Aggregatzustand flüssig
Dichte 0,78 g·cm−3 [1]
Schmelzpunkt Siedepunkt 82 °C [1]
Dampfdruck Löslichkeit vollständig mischbar mit Wasser[1], Ethanol, Aceton, Chloroform, Benzol
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 

Leicht-
entzündlichReizend (F) (Xi) R- und S-Sätze R: 11-36-67 S: (2)-7-16-24/25-26 MAK 200 ml·m−3 bzw. 500 mg·m−3 [1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. 2-Propanol, auch als Isopropylalkohol oder Isopropanol (abgekürzt IPA) bekannt, ist der einfachste nicht-cyclische, sekundäre Alkohol.
Inhaltsverzeichnis
Eigenschaften
Physikalische Eigenschaften
Isopropanol ist eine schnell verdunstende, farblose, brennbare Flüssigkeit, die einen leicht süßlich-angenehmen, bei stärkerem Einatmen jedoch stechenden Geruch besitzt – dieser ist charakteristisch und erinnert an Krankenhäuser und Arztpraxen, da Isopropanol Bestandteil vieler Desinfektionsmittel ist. Isopropanol ist mit Wasser in jedem Verhältnis homogen mischbar und bildet ein konstant siedendes (azeotropes) Gemisch bei 80,4 °C und 12,1 % Wasseranteil.
Thermodynamische Eigenschaften
Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,57795, B = 1221.423 und C = -87.474 im Temperaturbereich von 359,0 bis 508,24 K.[3]
Zusammenstellung der wichtigsten thermodynamischen Eigenschaften Eigenschaft Typ Wert [Einheit] Bemerkungen Standardbildungsenthalpie ΔfH0liquid
ΔfH0gas−318,2 kJ·mol−1[4]
−272,3 kJ·mol−1 [4]Standardentropie S0liquid 180,58 J·mol−1·K−1[5] als Flüssigkeit Verbrennungsenthalpie ΔcH0liquid −2005,8 kJ·mol−1[4] Wärmekapazität cp 161,2 J·mol−1·K−1 (25 °C)[6]
89,32 J·mol−1·K−1 (25 °C)[7]als Flüssigkeit
als GasKritische Temperatur Tc 508,3 K [8] Kritischer Druck pc 47,6 bar [8] Schmelzenthalpie ΔfH0 5,41 kJ·mol−1 [5] beim Schmelzpunkt Verdampfungsenthalpie ΔVH0 39,85 kJ·mol−1 [9] beim Normaldrucksiedepunkt Die Temperaturabhängigkeit der Verdampfungsenthalpie lässt sich entsprechend der Gleichung ΔVH0=Aexp(−αTr)(1−Tr)β (ΔVH0 in kJ/mol, Tr =(T/Tc) reduzierte Temperatur) mit A = 53,38 kJ/mol, α = −0,708, β = 0,6538 und Tc = 508,3 K im Temperaturbereich zwischen 298 K und 380 K beschreiben. [9]
Sicherheitstechnische Kenngrößen
2-Propanol bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei 12 °C. Der Explosionsbereich liegt zwischen 2 Vol% (50 g/m3) als untere Explosionsgrenze (UEG) und 13,4 Vol% (335 g/m3) als obere Explosionsgrenze (OEG).[10] Eine Korrelation der Explosionsgrenzen mit der Dampfdruckfunktion ergibt einen unteren Explosionspunkt von 10 °C sowie einen oberen Explosionspunkt von 39 °C. Die Grenzspaltweite wurde mit 0,99 mm bestimmt.[10] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA.[10] Die Zündtemperatur beträgt 425 °C. [10] Der Stoff fällt somit in die Temperaturklasse T2. Die elektrische Leitfähigkeit ist mit 5,8·10-6 S·m-1 eher gering.[11] In wäßrigen Lösungen ändert sich der Flammpunkt mit <20 °C bis zu einem Wassergehalt von 80 Mol% nur wenig.[12]
Dampfdruckfunktion und Explosionsbereich von 2-Propanol
Flammpunktsfunktion von 2-Propanol/Wasser-Gemischen
Chemische Eigenschaften (Sicherheit)
2-Propanol kann, wie andere sekundäre Alkohole auch,[13] mit Luftsauerstoff explosionsfähige Peroxide bilden.[14][15][16] So wurde beispielsweise in Behältern, in denen Isopropanol zehn Jahre aufbewahrt worden war, ein Peroxidgehalt von 1 % festgestellt; Peroxid-Konzentrationen bis 4,2 % wurden berichtet.[13] Beim Abdestillieren von 2-Propanol bis zur Trockne ist es deshalb zu teils schweren Unfällen gekommen. Es ist daher ratsam, Isopropanol vor dem Abdestillieren auf Peroxide zu prüfen.
Toxikologie
Die Dämpfe wirken betäubend. Der Kontakt verursacht Reizungen der Augen und der Schleimhäute. Beim Umgang für ausreichende Lüftung sorgen. In Tierversuchen wurden keine Hinweise auf sensibilisierende oder mutagene Eigenschaften gefunden.
Herstellung
Die großtechnische Herstellung erfolgt auf zwei verschiedenen Wegen, ausgehend von Propen oder von Aceton. Die Herstellung aus Propen erfolgt durch Hydratisierung an sauren Ionentauscherharzen als Katalysator:
Ausgehend von Aceton erfolgt die Herstellung von Isopropanol durch Hydrierung:
Durch Umkehrung dieser Reaktion wird großtechnisch Aceton aus Isopropanol durch Oxidehydrierung erzeugt, d.h. Dehydrierung mit gleichzeitiger Oxidation des entstandenen Wasserstoffs mit Sauerstoff zu Wasser.
Verwendung
- Lösungsmittel für Fette, Harze, Lacke, Tinte
- Extraktion und Reinigung von Naturprodukten
- Lösungsmittel zur Kristallisation und Reinigung organischer Substanzen
- Präzipitation von Nucleinsäuren
- Reinigungsmittel in Industrie und Haushalt/Fettlöser
- Lösungs- und Verdünnungsmittel in kosmetischen und pharmazeutischen Zubereitungen
- Zusatz zu Frostschutzmitteln im Kühlsystem oder in der Scheibenwaschanlage in Autos und LKW
- Bestandteil von Türschlossenteisern
- Bestandteil sogenannter Kraftstoffsystemreiniger, die dem Treibstoff von Kraftfahrzeugen beigegeben werden, um Rückstände und Wasser im System zu lösen
- Zusatz in Offsetdruckmaschinen mit Alkoholfeuchtwerken, um die Oberflächenspannung des Feuchtmittels herabzusetzen (sogenannter „Wischwasserzusatz“)
- Herstellung von Desinfektionsmitteln (70 %iger IPA in Wasser besitzt beispielsweise eine höhere Wirkung als entsprechend verdünntes Ethanol)
- Entschäumungsmittel
- Herstellung von Aceton (Meerwein-Ponndorf-Verley-Reduktion)
- Herstellung von Isopropylamin
- zum Nass-Abspielen von Schallplatten: 50 % Isopropanol gemischt mit 50 % destilliertem Wasser
- zum Tränken von Briefmarken zum Sichtbarmachen von Wasserzeichen
Weblinks
Quellen
- ↑ a b c d e f g Eintrag zu 2-Propanol in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 12. Sep. 2007 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 67-63-0 im European chemical Substances Information System ESIS
- ↑ Ambrose, D.; Townsend, R., Thermodynamic Properties of Organic Oxygen Compounds. Part 9. The Critical Properties and Vapour Pressures, above Five Atmospheres, of Six Aliphatic Alcohols, J. Chem. Soc., 1963, 3614-3625.
- ↑ a b c Snelson, A.; Skinner, H.A., Heats of combustion: sec-propanol, 1,4-dioxan, 1,3-dioxan and tetrahydropyran in Trans. Faraday Soc. 57 (1961) 2125-2131.
- ↑ a b Andon, R.J.L.; Counsell, J.F.; Martin, J.F., Thermodynamic properties of organic oxygen compounds. Part II. The thermodynamic properties from 10 to 330 K of isopropyl alcohol in Trans. Faraday Soc. 59 (1963) 1555-1558.
- ↑ Roux, G.; Roberts, D.; Perron, G.; Desnoyers, J.E., Microheterogeneity in aqueous-organic solutions: heat capacities, volumes and expansibilities of some alcohols, aminoalcohol and tertiary amines in water in J. Solution Chem. 9 (1980) 629-647.
- ↑ Thermodynamics Research Center, Selected Values of Properties of Chemical Compounds., Thermodynamics Research Center, Texas A&M University, College Station, Texas, 1997.
- ↑ a b Gude, M.; Teja, A.S., Vapor-Liquid Critical Properties of Elements and Compounds. 4. Aliphatic Alkanols in J. Chem. Eng. Data 40 (1995) 1025-1036..
- ↑ a b Majer, V.; Svoboda, V., Enthalpies of Vaporization of Organic Compounds: A Critical Review and Data Compilation, Blackwell Scientific Publications, Oxford, 1985, 300
- ↑ a b c d E. Brandes, W. Möller: Sicherheitstechnische Kenndaten - Band 1: Brennbare Flüssigkeiten und Gase, Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH, Bremerhaven 2003.
- ↑ BG-Regel 132 Vermeidung von Zündgefahren infolge elektrostatischer Aufladungen, Stand Juli 2004, S. 125, Hauptverband der gewerblichen Berufsgenossenschaften, Bezug über Jedermann Verlag Heidelberg
- ↑ Liaw, H.-J.; Chiu, Y.Y.: The prediction of the flash point for binary aqueous-organic solutions in J. Hazard. Mat. 101 (2003) 83 - 106
- ↑ a b BGChemie.de, Unfälle durch Peroxide bildende Substanzen
- ↑ Miratzal, Baumgarten, in J Chem Ed, 65/1988, S.226–229
- ↑ Sharples, in J Chem Ed, 61/1984, S. 476
- ↑ Bathe, in Chem Ber, 10/1974, S. 143
Wikimedia Foundation.