- O-Acetylserin
-
Strukturformel 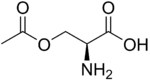
Allgemeines Name O-Acetylserin Andere Namen - O-Acetyl-L-serin
- (2S)-3-Acetyloxy-2-aminopropansäure
Summenformel C5H9NO4 CAS-Nummer 5147-00-2 PubChem 99478 DrugBank DB01837 Kurzbeschreibung weißes kristallines Pulver[1]
Eigenschaften Molare Masse 147,13 g·mol−1 Aggregatzustand fest
Löslichkeit löslich in Methanol[1]
Sicherheitshinweise EU-Gefahrstoffkennzeichnung [2] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Die chemische Verbindung O-Acetylserin (OAS) ist eine natürlich vorkommende, nicht proteinogene Aminosäure. Sie spielt in Bakterien und Pflanzen als Ausgangssubstanz für die Synthese von Cystein sowie als Sensor für die Verfügbarkeit reduzierten Schwefels eine Rolle.
Inhaltsverzeichnis
Biochemie
Die Synthese von O-Acetylserin wird von Serinacetyltransferasen katalysiert, wobei L-Serin mit Acetyl-Coenzym A als Cofaktor an der Hydroxygruppe acetyliert wird. Durch Schwefelwasserstoff unter Abspaltung von Acetat zu Cystein umgesetzt.[3]
Signalcharakter
Bei Schwefelmangel akkumuliert das nicht weiter zu Cystein umgesetzte O-Acetylserin und kann in Pflanzen dann als Signalsubstanz für eben diesen Schwefelmangel dienen. In der Folge wird die Expression von Genen der Schwefelassimilation gesteigert. Insbesondere reguliert O-Acetylserin auch seine eigene Bildung, da es zur Dissoziation des aus Serinacetyltransferase und O-Acetylserin(thiol)lyase gebildeten Cystein-Synthase-Komplex führt. Da Serinacetyltransferasen nur in diesem Komplex aktiv sind, wird hierdurch die Synthese von O-Acetylserin gebremst.[4]
Einzelnachweise
- ↑ a b O-Acetyl-L-serine (mpbio)
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Anna Feldman-Salit, Markus Wirtz, Ruediger Hell, Rebecca C. Wade1: A Mechanistic Model of the Cysteine Synthase Complex. In: Journal of Molecular Biology. 386, 2009, S. 37–59.
- ↑ Hankuil Yi, Ashley Galant, Geoffrey E. Ravilious, Mary L. Preuss, Joseph M. Jez: Sensing Sulfur Conditions: Simple to Complex Protein Regulatory Mechanisms in Plant Thiol Metabolism. In: Molecular Plant. 3, Nr. 2, 2010, S. 269–279.
Weblinks
- Eintrag in der Human Metabolome Database (englisch)
Wikimedia Foundation.
