- α-Phenylglycin
-
Strukturformel 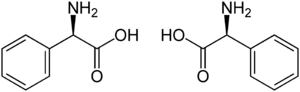
D-Phenylglycin (links) und L-Phenylglycin (rechts) Allgemeines Name α-Phenylglycin Andere Namen - (R)-2-Amino-2-phenylessigsäure
- D-(–)-Phenylglycin
- D-2-Phenylglycin
- (S)-2-Amino-2-phenylessigsäure
- L-(+)-Phenylglycin
- L-2-Phenylglycin
- DL-2-Phenylglycin
- (RS)-2-Phenylglycin
- (±)-2-Phenylglycin
Summenformel C8H9NO2 CAS-Nummer - 875-74-1 (D-Phenylglycin)
- 2935-35-5 (L-Phenylglycin)
- 2835-06-5 (DL-Phenylglycin)
PubChem 70134 Kurzbeschreibung weißes kristallines Pulver[1]
Eigenschaften Molare Masse 151,16 g·mol−1 Aggregatzustand fest
Schmelzpunkt Löslichkeit schlecht in Wasser (3 g·l−1 bei 20 °C)[2]
Sicherheitshinweise EU-Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. D-Phenylglycin [Synonym:(R)-Phenylglycin] ist eine ökonomisch bedeutende, in der Natur nicht vorkommende, nicht-proteinogene α-Aminocarbonsäure. Sie ist in der Seitenkette mehrerer semisynthetischer β-Lactam-Antibiotika als Teilstruktur enthalten, etwa im Ampicillin. Die enantiomere Aminosäure L-Phenylglycin [Synonym:(S)-α-Phenylglycin] besitzt nur untergeordnete Bedeutung.
Inhaltsverzeichnis
Darstellung
D-Phenylglycin kann durch Spaltung des Racemats DL-Phenylglycin mit Hilfe von D-Campher-10-sulfonsäure, in der Gegenwart von Essigsäure und Salicylaldehyd erhalten werden. Die Ausbeute bei diesem Verfahren beträgt 68 % bei einer optischen Reinheit von 95,9 %.[3]
Die enzymatische Darstellung von D-Phenylglycin aus Phenylpyruvat gelang 2006.[4] Phenylpyruvat ist ein direkter Vorläufer des L-Phenylalanins. Daher wurde für die Darstellung ein E. coli-Stamms eingesetzt, der auf die Produktion von L-Phenylalanin auf Basis von Glucose optimiert war. Die Umwandlung des Phenylpyruvats erfolgte über Mandelat und Phenylglyoxylat in drei Stufen. Diese wurden durch drei Enzyme (Hydroxymandelat-Synthase (HmaS), Hydroxymandelat-Oxidase (Hmo) und die stereoinvertierende Hydroxyphenylglycin-Aminotransferase (HpgAT)) katalysiert. Die diese Enzyme kodierenden Gene stammten aus Amycolatopsis orientalis, Streptomyces coelicolor und Pseudomonas putida.
Eigenschaften
D-Phenylglycin ist ein farbloser Feststoff, der sich bei 305 °C zersetzt. Der Drehwert α einer 1-molaren Lösung in 1-molarer Salzsäure beträgt bei 20 °C und einer Wellenlänge von 589 nm –155°.[5]
Verwendung
D-Phenylglycin ist ein wichtiger Seitenketten-Baustein für die halbsynthetische Gewinnung von β-Lactam-Antibiotika, wie Cefalexin oder Ampicillin.[4]
Einzelnachweise
- ↑ a b c Datenblatt α-Phenylglycin bei AlfaAesar, abgerufen am 19. Februar 2010 (JavaScript erforderlich).
- ↑ Datenblatt α-Phenylglycin bei Acros, abgerufen am 19. Februar 2010.
- ↑ Chikara Hongo, Ryuzo Yoshioka, Masanori Tohyama, Shigeki Yamada, Ichiro Chibata: "Racemization of Optically Active Amino Acid Salts and an Approach to Asymmetric Transformation of DL-Amino Acids", in: Bull. Chim. Soc. Jap., 1983, 56, S. 3744–3747; doi:10.1246/bcsj.56.3744; beschrieben in Patentschrift WO 1995023805.
- ↑ a b U. Müller, F. van Assema, M. Gunsior, S. Orf, S. Kremer, D. Schipper, A. Wagemans, C. A. Townsend, T. Sonke, R. Bovenberg, M. Wubbolts: "Metabolic engineering of the E. coli L-phenylalanine pathway for the production of D-phenylglycine (D-Phg)", in: Metab Eng., 2006, 8 (3), S. 196–208; PMID 16466681.
- ↑ Datenblatt α-Phenylglycin bei Sigma-Aldrich, abgerufen am 19. Februar 2010.
Wikimedia Foundation.
