- Indigo
-
Strukturformel 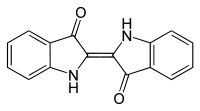
Allgemeines Name Indigo Andere Namen - Indigotin
- 2,2’-Bis(2,3-dihydro-3-oxoindolyliden)
- C.I. Pigment Blue 66
- C.I. 73000
Summenformel C16H10N2O2 CAS-Nummer 482-89-3 PubChem 5318432 Kurzbeschreibung dunkelblauer, geruchloser kristalliner Feststoff [1]
Eigenschaften Molare Masse 262,27 g·mol−1 Aggregatzustand fest
Schmelzpunkt 390–392 °C (Sublimation)[2]
Löslichkeit Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [3] 
Achtung
H- und P-Sätze H: 315-319-335 EUH: keine EUH-Sätze P: 261-305+351+338 [3] EU-Gefahrstoffkennzeichnung [1] 
Reizend (Xi) R- und S-Sätze R: 36/37/38 S: 26-36 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Indigo (von span., lat., griech.: indikón das Indische, nach der Heimat Ostindien) ist ein tiefblauer Farbstoff und namensgebend für seinen Farbton Indigo. Am ehesten lässt er sich als der letzte erkennbare Blauton, bevor es in ein bläuliches Violett übergeht, umschreiben. Indigo ist im Colour Index als C.I. Pigment Blue 66 und C.I. 73000 geführt.
Inhaltsverzeichnis
Vorkommen und Gewinnung
Indigo kann pflanzlich aus der indischen Indigopflanze oder dem alteingebürgerten Färberwaid gewonnen werden. Im Mittelalter kannte man in Europa keinen anderen blauen Farbstoff als Indigo. Vom 12. bis zum 17. Jahrhundert wurde Färberwaid in Thüringen angebaut, wobei nach Schätzungen ungefähr 3750 ha mit der Pflanze bestellt waren. Der aus dem Waid gewonnene Brei wurde zu Waidkugeln getrocknet und nach Bedarf, vorwiegen in den Wintermonaten, mit Urin angefeuchtet und nach Zugabe von Pottasche vergoren. 300 kg Pflanzenmaterial lieferten etwa 1 bis 1,5 kg Indigo. Die Indigofera-Pflanze in Indien lieferte die dreißigfache Farbstoffmenge im Vergleich zu Färberwaid, so dass der Anbau in Europa im 17. Jahrhundert unrentabel wurde.[5] Als Ersatz für Indigo wurde von amerikanischen Siedlern der Bastardindigo (Amorpha fruticosa) für das Blaufärben benutzt. Heute wird Indigo noch in Brasilien und El Salvador kultiviert. Man nutzt die farbstoffreichen Arten Indigofera arrecta und I. sumatrana.
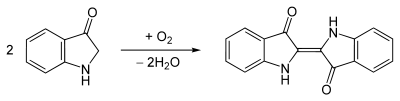
Die Pflanzen enthalten jedoch kein Indigo, sondern Indican, das zunächst durch Gärung in Indoxyl umgewandelt werden muss. Durch anschließende Oxidation an der Luft entsteht aus dem gelben Indoxyl der blaue Indigo, diese Arbeitsgänge entsprechen der Küpenfärberei.
Herstellung
Die Gewinnung aus der Indigopflanze lässt sich bis ins Altertum nachweisen. Bereits in vorchristlicher Zeit finden sich Indigofera-Arten in Indien, Ostasien und Ägypten. Der Färberwaid wurde im Mittelmeerraum bereits in der Antike zum Färben genutzt.
1870 gelang erstmals die vollsynthetische Herstellung von Indigo aus Isatin durch den deutschen Chemiker Adolf von Baeyer.[6] Von Baeyer entwickelte zwischen 1880 und 1882 weitere Syntheserouten für Indigo über Zimtsäure und o-Nitrobenzaldehyd. Ein Vorprodukt, die o-Nitrophenylpropiolsäure, ließ sich direkt auf der Textilfaser zu Indigo reduzieren.[7] Die BASF errichtete schon 1881 eine kleine Produktion vom „Kleinen Indigo“. Der wirtschaftliche Erfolg blieb jedoch aus, die Produktion wurde eingestellt.
Im Jahr 1890 entwickelte der Zürcher Professor Karl Heumann eine neue Syntheseroute über Phenylglycin. Der Chemiekonzern BASF und die Hoechst AG patentierten und entwickelten das Verfahren weiter. Die Versuchsreihe mit Phenylglycin wurde von der BASF im Jahr 1893 wieder eingestellt, da die Indigoausbeute sehr niedrig war.[7] Ein guter Ansatz war jedoch mit Phenylglycin-o-carbonsäure möglich. Die BASF konnte Phthalsäure (ein wichtiges Vorprodukt) recht günstig aus Naphthalin herstellen. Seit 1897 wird synthetischer Indigo kommerziell nach dem genannten Verfahren von der BASF hergestellt.
1901 war es Johannes Pfleger bei der Degussa gelungen, aus N-Phenylglycin mittels Natriumamid und einer Alkalischmelze Indigo in hohen Ausbeuten zu erhalten.
Dieses Verfahren setzte sich zunächst bei BASF und Hoechst durch. Ab 1904 wurde ein sehr viel besseres Verfahren über Anilin und Ethylenchlorhydrin entwickelt, dabei entsteht 2-Anilinoethanol, das sich unter Baseneinfluss und höheren Temperaturen bei sehr guten Ausbeuten zu Indoxyl umwandelt.
Die synthetische Herstellung von Indigo verdrängte völlig die mühsame Gewinnung aus Pflanzenmaterial. Die Vorteile der synthetischen Indigogewinnung sprechen für sich: farbkräftigere Ergebnisse, eine leichtere Dosierung, keine Ernteabhängigkeit und keine wechselnden Farbqualitäten.
Vor dem Ersten Weltkrieg war Indien, die wichtigste britische Kolonie, der weltweit bedeutendste Produzent von Indigo:
2.619.000 kg, 80 % der Weltproduktion. Die in Deutschland entwickelten Anilinfarben konkurrierten erfolgreich:- Deutsche Anilinlieferungen
- 1897: 5.079 kg entsprechend 15 % vom Weltmarkt
- 1900: 1.871.850 kg entsprechend 56 % vom Weltmarkt
- 1902: 7.232.900 kg entsprechend 217 % des ehemaligen Weltmarkvolumens[8]
Ab dem Jahr 1924 basierte die Indigosynthese aus Phenylglycinnitril, das aus Anilin, Formaldehyd und Cyanwasserstoff hergestellt wurde.[7] In allen Fällen entsteht Indoxyl, was durch Luftsauerstoff zu Indigo oxidiert.
Eigenschaften
Indigo selbst ist fast wasserunlöslich und muss vor dem Färben durch Reduktion in das wasserlösliche Indigoweiß (Leuko-Indigo) umgewandelt werden. Nach dem Färben entsteht durch Oxidation wieder Indigo. Diesen Vorgang, der so auch bei anderen Textilfarbstoffen angewandt wird, bezeichnet man als Küpenfärberei. Früher wurden zur Oxidation des Farbstoffs die Stoffe auf einer Wiese in die Sonne gelegt, wo das Indigo durch den bei der Photolyse entstehenden Singulett-Sauerstoff oxidiert wurde. In Verbindung mit der Vorstellung, dass die Färber während dieses Trocknungsvorganges nichts zu tun gehabt hätten, ist die These aufgekommen, dass hieraus der umgangssprachliche Ausdruck blau machen für „Nichtstun, seiner Arbeit fernbleiben“ entstanden sei, für den in der sprachwissenschaftlichen Literatur jedoch andere Herkunftserklärungen angeboten werden.
Beim Färben von Textilien mit Indigo kann man auch grüne Farbtöne erzielen. Dies wird durch eine Überfärbung mit Reseda (Färberwau) erreicht.
Indigo besitzt einen recht hohen Schmelzpunkt (ca. 390 °C) und ist schlecht löslich. Dies begründet sich darin, dass Indigo im festen Zustand ein Wasserstoffbrücken-Polymer bildet.[9] Röntgendiagramme haben gezeigt, dass dabei jedes Indigomolekül an vier umgebende Moleküle gebunden ist.[10]
Indigoide Farbstoffe
Indigoide Farbstoffe sind strukturell dem Indigo verwandte Stoffe:
- Ein rotvioletter, zum Indigo strukturisomerer Farbstoff ist Indirubin
- Indigokarmin (5,5'-Indigodisulfonsäure-Dinatriumsalz)
- Purpur (6,6'-Dibromindigo)
Ein Abbauprodukt des Indigo ist Isatin.
Name Grundstruktur X λmax (nm) (in Ethanol)[11] Indigo 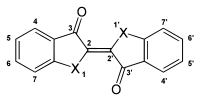
NH 606 Selenindigo Se 562 Thioindigo S 543 Oxindigo O 432 Verwendung
Die Maya stellten das rituell verwendete Pigment Maya-Blau aus dem Mineral Palygorskit und Indigo her.
Um 1900 gab es für Indigo einen riesigen Markt. Es wurden Waffenröcke, Matrosenuniformen und die blaue Arbeitskleidung der Arbeiter mit diesem Farbstoff gefärbt.
Während der natürliche Indigo nur noch einen geringen Marktanteil besitzt, ist der künstliche Indigo ein wichtiger Farbstoff für die von Levi Strauss im Jahre 1873 erfundenen Jeans. In der Textilindustrie ist der synthetisch hergestellte Indigo als Küpenfarbstoff weit verbreitet.[12][13] Größtenteils wird Indigo zum Färben von Denim-Stoffen benötigt.
Für den technischen Einsatzbereich lässt sich Indigo in Form dünner organischer Filme für den Bau von Solarzellen verwenden.[14]
Literatur
- Fritz Lauterbach: Der Kampf des Waides mit dem Indigo. Leipzig 1905.
- Kaiser-Alexnat, R.: Indigo – Der König der Farbstoffe. Südostasien Magazin, Ausgabe 3, 110-121, 2008. (PDF 888 KB)
- Helmut Schmidt: Indigo - 100 Jahre industrielle Synthese, Chemie in unserer Zeit, 3/97, S. 121 - 128
- Jenny Balfour-Paul: Indigo. London 1998.
- Frits Cowan: Indigo - Natuurlijk Blauw. Amsterdam 1985.
- Frederik H. Gerber: Indigo and the Antiquity od Dyeing. Ormond-Beach, 1977.
- Gösta Sandberg: Indigo Textiles – Technique and History. London 1989.
- Harald Paland: Blau, Praxis der Naturwissenschaften - Chemie, Nr. 6/60, S. 26-29, Aulis Verlag 2011
Weblinks
Einzelnachweise
- ↑ a b c Eintrag zu Indigo in der GESTIS-Stoffdatenbank des IFA, abgerufen am 16. Dez. 2007 (JavaScript erforderlich)
- ↑ a b c Norbert Welsch: Indigo. In: Römpp Chemie-Lexikon, Thieme Verlag, Stand März 2006.
- ↑ a b Datenblatt Indigo bei Sigma-Aldrich, abgerufen am 5. April 2011.
- ↑ Kupferstich aus der Histoire générale des Antilles von Jean-Baptiste du Tertre (1667)
- ↑ Christian-Herbert Fischer: Historische organische Farbstoffe, Spektrum der Wissenschaften, Oktober 1997, S. 104 ff
- ↑ A. Bayer, A. Emmerling: Reduktion des Isatins zu Indigoblau, Ber. Dtsch. Chem. Ges. 1870, 3, 514–517
- ↑ a b c Helmut Schmidt: Indigo – 100 Jahre industrielle Synthese, Chemie in unserer Zeit, 3/97, S. 121 ff.
- ↑ Ehrhardt Bödecker, Preußische Allgemeine Zeitung, Nr. 14, 10. April 2010, S. 3.
- ↑ Paul Rys und Heinrich Zollinger: Farbstoffchemie. Ein Leitfaden. Wiley-VCH, 3. neubearb. Auflage 1982, Seite 137, ISBN 3-527-25964-3.
- ↑ Eller, H. v. (1955); Bull. soc. chim. France 106(1426).
- ↑ Paul Rys und Heinrich Zollinger: Farbstoffchemie. Ein Leitfaden. Wiley-VCH; 3. neubearb. Auflage 1982; ISBN 3-527-25964-3; Seite 136
- ↑ Gilbert nee Stoker, KG. und Cooke, DT. (2001): Dyes from plants: Past usage, present understanding and potential. In: Plant Growth Regulation 34(1); 57–69.
- ↑ Balan, DS. und Monteiro, RT. (2001): Decolorization of textile indigo dye by ligninolytic fungi. In: J Biotechnol. 89(2-3); 141–5, PMID 11500207.
- ↑ Uehara, K. et al. (1987): The Al/Indigo/Au photovoltaic cell. In: Solar Cells 22(4), 1987, 295–301.
Wikimedia Foundation.