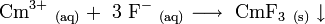- CmF3
-
Kristallstruktur Keine Kristallstruktur vorhanden Allgemeines Name Curium(III)-fluorid Andere Namen Curiumtrifluorid
Verhältnisformel CmF3 CAS-Nummer 13708-79-7 Kurzbeschreibung farbloser Feststoff[1] Eigenschaften Molare Masse je nach Isotop: 295–309 g/mol Aggregatzustand fest
Schmelzpunkt Löslichkeit praktisch unlöslich in Wasser (10 mg/l)[2]
Sicherheitshinweise Gefahrstoffkennzeichnung [3] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Radioaktivität 
RadioaktivSoweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Curium(III)-fluorid ist eine chemische Verbindung bestehend aus den Elementen Curium und Fluor. Es besitzt die Formel CmF3 und gehört zur Stoffklasse der Fluoride.
Darstellung
Curium(III)-fluorid kann durch die Umsetzung einer wässrigen Curiumlösung mit Fluoridsalzen im schwach Sauren hergestellt werden.
Eine zweite Möglichkeit ist durch die Umsetzung von Curium(III)-hydroxid mit Flusssäure gegeben. Auf diese Arten hergestelltes Cm(III)-fluorid enthält immer einige Moleküle Kristallwasser. Das wasserfreie Salz kann durch Trocknung mit heißem gasförmigem Fluorwasserstoff oder durch Trocknung im Exsikkator über Phosphor(V)-oxid erhalten werden.[1]
Eigenschaften
Cm(III)-fluorid ist ein farbloser Feststoff, der bei 1406 °C schmilzt. Die molare Masse ist abhängig vom verwendeten Isotop, beziehungsweise der Isotopenzusammensetzung.
Es kristallisiert in der Lanthanfluoridstruktur. Hierbei ist jeder Curiumkern von neun Fluorkernen in einer verzerrten dreifach-überkappten trigonal-prismatischen Struktur umgeben.[4] Die Standardbildungsenthalpie ΔH0 wird auf 1660 kJ/mol abgeschätzt, die Bildungsentropie ΔS0 auf 121 J·mol-1K-1 (298 K).[5][2]Quellen
- ↑ a b c Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements, Springer-Verlag, Dordrecht 2006, ISBN 1-4020-3555-1.
- ↑ a b B. B. Cunningham, Prep. Inorg. Reactions 1966, 3, 79–121.
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ R. A. Penneman, R. R. Ryan, A. Rosenzweig, Struct. Bonding, 1973, 13, 1–52.
- ↑ J. Burnett, J. Inorg. Nucl. Chem. 1966, 28, 2454–2456.
Wikimedia Foundation.