- Desmosin
-
Strukturformel 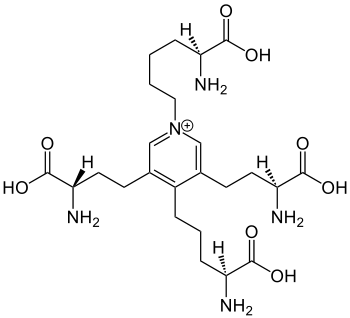
Allgemeines Name Desmosin Andere Namen 4-((4S)-4-Amino-4-carboxybutyl)-1-((5S)-5-amino-5-carboxypentyl)-3,5-bis((3S)-3-amino-3-carboxypropyl)pyridinium
Summenformel C24H40N5O8 CAS-Nummer 11003-57-9 PubChem 25435 Eigenschaften Molare Masse 526,60 g·mol−1 Sicherheitshinweise EU-Gefahrstoffkennzeichnung [1] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Desmosin ist eine Aminosäure, die aus vier L-Lysin-Molekülen gebildet wird.[2] Desmosin und das verwandte Isodesmosin sind Komponenten des Faserproteins Elastin.
Biosynthese
Bei der Biosynthese von Desmosin werden zunächst die endständigen Aminogruppen der L-Lysin-Einheiten durch das Enzym Lysyloxidase (EC 1.4.3.13) zu den entsprechenden ω-Aldehyden oxidiert. Aus Lysin entsteht so Allysin. Der Ringschluss zur Pyridinium-Substruktur entsteht aus drei Allysin-Einheiten und der Aminofunktion eines weiteren Lysin-Moleküls.[3]
Funktion
Da Desmosin formal eine Vierfach-Aminosäure mit einem zentralen Pyridin-Ring darstellt, kann sie im Elastin zum Vernetzen von Proteinsträngen dienen. Die beiden Aminosäuren fluoreszieren bläulich unter UV-Licht und verursachen die gelbe Farbe des Elastins, seine Wasserunlöslichkeit, Hitzestabilität und Resistenz gegen Alkalien und die meisten Proteasen mit Ausnahme der Elastase.[4]
Einzelnachweise
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ M. M. Cox, D. Nelson: Lehninger Biochemie. Springer-Verlag, 2005, ISBN 3-540-41813-X.
- ↑ Thieme Chemistry (Hrsg.): Eintrag zu Desmosine im Römpp Online. Version 3.14. Georg Thieme Verlag, Stuttgart 2011, abgerufen am 5. März 2011.
- ↑ H. P. T. Ammon: Hunnius pharmazeutisches Wörterbuch, 2004, Verlag Walter de Gruyter, ISBN 3-11-017475-8.
Wikimedia Foundation.
