- Nukleophile Addition
-
Die nukleophile Addition (siehe dazu: Nukleophilie) ist ein Reaktionsmechanismus in der organischen Chemie, bei dem ein Nukleophil (Anion oder Lewis-Base) eine Mehrfachbindung angreift. Das Nukleophil wird der angegriffenen Verbindung hinzugefügt (Addition). Es findet kein Austausch von Atomen oder Atomgruppen statt (vergleiche mit: Substitution).[1]
Inhaltsverzeichnis
Edukte
Nukleophil
Als Nukleophile können die verschiedensten Verbindungen eingesetzt werden. Dabei handelt es sich um elektronenreiche, meist freie Elektronenpaare enthaltende Moleküle oder Anionen (siehe unten: Beispiele).
Mehrfachbindungen
Nukleophile Additionen können an unterschiedlichen Typen von Mehrfachbindungen stattfinden:
- Addition an C=C-Doppelbindungen[2]
- Addition an C≡C-Dreifachbindungen
- Addition an konjugierte C-C-Mehrfachbindungen
- Addition an C-X-Mehrfachbindungen
Reaktionsverlauf
Das Nukleophil greift an dem Ende der Mehrfachbindung an, dessen Elektronendichte durch die induktiven Einflüsse von Substituenten herabgesetzt wurde. Dieses ist bei C-C-Mehrfachbindungen, bei denen ein Kohlenstoff-Atom mit elektronegativen Atomen oder Atomgruppen verbunden ist, oder bei C-X-Mehrfachbindungen der Fall.
Nukleophile Addition an C-C-Mehrfachbindungen
Der erste Schritt bei dieser Reaktion besteht in dem Angriff des Nukleophils am stärker positiv polarisierten Kohlenstoff unter Bildung eines Carbanions:
Im zweiten Schritt reagiert das Carbanion mit einem Elektronenakzeptor, meist einem Proton:
Die Bildung des Carbanions wird begünstigt, wenn die Substituenten dieses durch Mesomerie stabilisieren können. Man spricht dann von einer Michael-Addition, wobei das Nukleophil das Anion einer CH-aciden Verbindung ist.
Nukleophile Addition an C-X-Mehrfachbindungen
CX-Mehrfachbindungen kommen in folgenden Atomgruppen vor:
- Carbonylgruppe[3]
- Thiocarbonylgruppe[4]
- Isocyanatgruppe[5]
- Azomethingruppe
- Cyanogruppe
- Isocyanogruppe[5]
Hier kann ein Nukleophil am Kohlenstoff einer CX-Mehrfachbindung angreifen. Die andere Möglichkeit ist, dass zunächst das elektronenziehende Heteroatom in einem vorgelagerten Gleichgewicht protoniert wird und anschließend das Nukleophil am Kohlenstoff bindet.
Beispiele
Nukleophile Addition an C-C-Mehrfachbindungen
- Addition von Ammoniak oder Aminen
- Addition von Cyanwasserstoff
- Michael-Addition
Nukleophile Addition an C-X-Mehrfachbindungen
Die einzelnen nukleophilen Additionen an C-X-Mehrfachbindungen können anhand des angreifenden Nukleophils in Gruppen eingeteilt werden:
Sauerstoff als Nukleophil
- Hydratisierung
- Acetal-Bildung
Stickstoff als Nukleophil
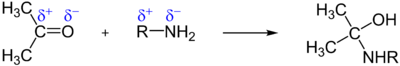
- Addition von primären Aminen: Diese Reaktion führt zu einer einem Halbacetal entsprechenden Verbindung (Halbaminal), die in einer Folgereaktion unter Wasserabspaltung in ein Azomethin übergeht.
- Addition von sekundären Aminen: Diese Reaktion führt letztendlich zu einem Enamin.
- Addition von Hydrazin
- Addition von Hydroxylamin
- Mannich-Reaktion
Schwefel als Nukleophil
- Mercaptal-Bildung
- Bisulfitaddition
Carbanionischer Kohlenstoff als Nukleophil
- Aldolreaktion
- Benzoin-Addition
- Cyanhydrin-Synthese
- Knoevenagel-Kondensation
- Perkin-Reaktion
- Reformatzky-Reaktion
- Stobbe-Kondensation
- Strecker-Synthese von Aminosäuren
- Wittig-Reaktion
Cycloaddition | Elektrophile Addition | Elektrophile Substitution | Elektrophile aromatische Substitution | Eliminierung | Nukleophile Addition | Nukleophile Substitution | Oxidation | Radikalische Addition | Radikalische Substitution | Reduktion | Umlagerung
Wikimedia Foundation.