- EGF-Rezeptor
-
EGF-Rezeptor Schemazeichnung. Die genaue Struktur ist noch nicht vollständig geklärt. Vorhandene Strukturdaten: Ektodomäne: 1IVO, 1MOX, 1NQL, 1YY9, 3B2U, 3B2V, 3C09; Juxtamembran-Domäne: 1Z9I (NMR); Tyrosinkinase: 1M14, 1M17, 1XKK, 2EB2, 2EB3, 2GS2, 2GS6, 2GS7, 2ITN, 2ITO, 2ITP, 2ITQ, 2ITT, 2ITU, 2ITV, 2ITW, 2ITX, 2ITY, 2ITZ, 2J5E, 2J5F, 2J6M, 2JIT, 2JIU, 2JIV, 2RF9, 2RFD, 2RFE, 2RGP, 3BEL, 3BUO, 3GOP, 3GT8 Masse/Länge Primärstruktur 1186 Aminosäuren (Monomer) Sekundär- bis Quartärstruktur single-pass Membranrezeptor, Dimer Isoformen 4 Bezeichner Gen-Name EGFR Externe IDs OMIM: 131550 UniProt: P00533 Enzymklassifikation EC, Kategorie 2.7.10.1 Tyrosinkinase Reaktionsart Phosphorylierung Substrat ATP + Protein-L-Tyrosin Produkte ADP + Protein-L-Tyrosinphosphat Vorkommen Übergeordnetes Taxon Wirbeltiere Der EGF-Rezeptor (Abkürzung für engl. Epidermal-Growth-Factor-Receptor, EGFR) ist ein Protein in Zellmembranen von Wirbeltieren; es ist der Rezeptor für den Epidermal-Growth-Factor (EGF) und ist ein Mitglied der ErbB-Familie, eine Unterfamilie von vier eng verwandten Rezeptor-Tyrosinkinasen: EGFR1/HER1 (ErbB-1), HER2/c-neu (ErbB-2), HER3 (ErbB-3) und HER4 (ErbB-4).
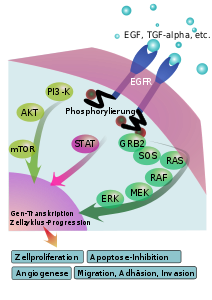
Der EGF-Rezeptor ist ein Transmembranrezeptor mit intrinsischer Tyrosinkinase-Aktivität, der beim Mensch in allen Zellarten vorkommt. Der Rezeptor hat nur einen einzigen Membrandurchgang und im cytoplasmatischen Teil eine Kinase-Domäne mit ATP-Bindungsstelle. Die Aktivierung (Dimerisierung) des EGFR erfolgt durch extrazelluläre Bindung der Liganden Epidermal Growth Factor (EGF) und Transforming Growth Factor (TGFα), dessen Signal er über Autophosphorylierung und die Rekrutierung von Signalmolekülen wie Akt/PKB, MEK oder STAT-Protein ins Zellinnere leitet (Signaltransduktion), die letztendlich das Zellwachstum stimulieren und den apoptotischen (programmierten) Zelltod verhindern. Der EGF-Rezeptor gehört somit zu den Rezeptoren für Wachstumsfaktoren.
1,25(OH)2D3 hemmt diesen Rezeptor-Liganden-Komplex, was möglicherweise zu der Wirksamkeit von Vitamin D in der Psoriasisbehandlung beiträgt, weil psoriatische Zellen vermehrt TGFα bilden.
Der EGF-Rezeptor wird in verschiedenen Tumorarten hochreguliert und/oder in mutierter Form vorgefunden, was dazu führt, dass die Tumorzellen unkontrolliert wachsen und sich vermehren. In Folge kann es zu einer verstärkten Metastasenbildung kommen. Ferner gibt es auch geringere Sensitivität gegenüber Chemo- und Radiotherapie.
Neuartige Krebstherapien zielen darauf ab, dieses onkogene Signal von EGFR zu blockieren und somit das Tumorwachstum zu unterbinden. Bereits erfolgreich getestete und zugelassene Substanzen dieser sogenannten gezielten Krebstherapie (engl. targeted therapy) sind unter anderem Gefitinib (Iressa), Erlotinib (Tarceva) oder die monoklonalen Antikörper Cetuximab (Erbitux) und Panitumumab (Vectibix).[1]
Inhaltsverzeichnis
Proteinstruktur
Die Struktur des EGFR-Monomers besteht aus:
- der Ektodomäne (extrazelluläre Domäne) mit zwei homologen Domänen I (L1) und III (L2) und den cysteinreichen Domänen II (CR1 bzw. S1) und IV (CR2 bzw. S2)
- einer single-pass transmembranen α-Helix
- der katalytischen Region im Zytoplasma mit der Tyrosinkinase flankiert durch Juxtamembran- und C-terminaler regulatorische Region.
Bisher ist die Gesamtstruktur des Dimers unbekannt, wesentlich Teile aber bereits bestimmt worden: Domänen I-III und einige wenige Reste der Domäne IV (Einkristall), die Juxtamembranregion alleine (NMR) bzw. zusammen mit der Tyrosinkinase (Einkristall) und auch die Tyrosinkinase alleine (Einkristall).
Literatur
- Oda K, Matsuoka Y, Funahashi A, Kitano H: A comprehensive pathway map of epidermal growth factor receptor signaling. Mol Syst Biol. 2005;1:2005.0010. PMID 16729045
- Dutta PR, Maity A: Cellular responses to EGFR inhibitors and their relevance to cancer therapy. Cancer Lett. 2007 Sep 8;254(2):165-77. Review. PMID 17367921
Weblinks
Einzelnachweise
- ↑ F. Ciardiello et al., EGF-Rezeptorblockade mit monoklonalen Antikörpern und so genannten «small molecules», Onkologie - International Journal for Cancer Research and Treatment 2005; Vol. 28(suppl 4):18-24
Wikimedia Foundation.