- E 341
-
Strukturformel 3 · Ca2+ + 2 · 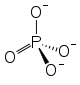
Allgemeines Name Calciumphosphat Andere Namen - Tricalciumphosphat
- Tribasisches Calciumphosphat
- Calciumorthophosphat
- Tricalciummonophosphat
- Tertiäres Calciumphosphat
- E 341
Summenformel Ca3(PO4)2 CAS-Nummer 7758-87-4 PubChem 24456 ATC-Code A12AA01
Kurzbeschreibung weißer Feststoff Eigenschaften Molare Masse 310,18 g/mol Aggregatzustand fest
Dichte 3,14 g/cm3[1]
Schmelzpunkt Siedepunkt nicht anwendbar[1]
Löslichkeit praktisch unlöslich (0,02 g/l[1]) in Wasser
Sicherheitshinweise Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln LD50 >5000 mg/kg[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Calciumphosphat, Tricalciumorthophosphat oder Tricalciumphosphat (Ca3(PO4)2) ist ein Calciumsalz der ortho-Phosphorsäure und gehört zu den Phosphaten. Der Begriff Tricalciumphosphat wird gelegentlich für die sehr ähnliche Verbindung Pentacalciumhydroxymonophosphat (Ca5(PO4)3·OH) verwendet.
Inhaltsverzeichnis
Vorkommen
Calciumphosphat ist ein wichtiger Bestandteil von Knochen und Zähnen. Es tritt in mineralischen Calciumphosphaten wie zum Beispiel Carbonatapatit oder Brushit auf.
Eigenschaften
Calciumphosphat ist ein farb- und geruchloser Feststoff, der bei 1670 °C schmilzt. Es ist praktisch unlöslich in Wasser.
Verwendung
Man verwendet das (wasserunlösliche) tertiäre Calciumphosphat zur Herstellung des (wasserlöslichen) primären Calciumphosphats Ca(H2PO4)2, besser bekannt als Superphosphat, ein weit verbreitetes Düngemittel.
Es dient auch zur Herstellung von Phosphorsäure, indem es mit Schwefelsäure reagiert.
Calciumphosphat wird neben ähnlichen Calciumphosphaten wie Calciumdihydrogenphosphat und Calciumhydrogenphosphat in Zahnpflegemitteln verwendet. Außerdem findet es Verwendung als Lebensmittelzusatzstoff (E 341c) z. B. für Fertigkuchenmischungen.
Quellen
Weblinks
Wikimedia Foundation.
