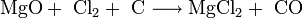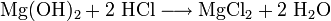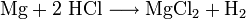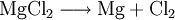- E 511
-
Kristallstruktur 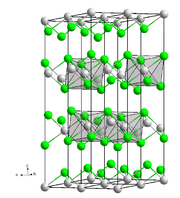
__ Mg2+ __ Cl- Allgemeines Name Magnesiumchlorid Andere Namen E 511
Verhältnisformel MgCl2 CAS-Nummer 7786-30-3 (wasserfrei)
7791-18-6 (Hexahydrat)Kurzbeschreibung weiße Kristalle Eigenschaften Molare Masse 95,21 g·mol–1 Aggregatzustand fest
Dichte 2,32 g·cm–3 (20 °C, wasserfrei) [1]
Schmelzpunkt 708 °C [1]
Siedepunkt 1412 °C [1]
Löslichkeit 542 g/L (20 °C) [1]
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 
Reizend (Xi) R- und S-Sätze R: 36/37 S: keine S-Sätze Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Magnesiumchlorid, MgCl2, ist das Magnesiumsalz der Salzsäure. Es bildet mehrere Hydrate.
Inhaltsverzeichnis
Vorkommen
Magnesiumchlorid kommt in der Natur im Mineral Carnallit (KMgCl3 · 6 H2O) als Doppelsalz vor. Eine weitere natürliche Quelle ist das Meerwasser.In manchen Salzseen ist Konzentration an Magnesium-Ionen sogar höher als die der Natrium-Ionen.
Gewinnung und Darstellung
Die technische Gewinnung von Magnesiumchlorid erfolgt durch Eindampfen der Endlaugen aus der Produktion von Kaliumchlorid. Dabei wird zuerst das Magnesiumchlorid-Hexahydrat (MgCl2 · 6H2O) erhalten. Weiteres Eindampfen liefert ein wasserärmeres Produkt. Wasserfreies Magnesiumchlorid wird durch Umsetzung von Magnesiumoxid mit Koks und Chlor gewonnen:
Im Labor kann Magnesiumchlorid aus Magnesiumhydroxid und Salzsäure
oder durch Umsetzung von Magnesium mit Salzsäure
gewonnen werden.
Eigenschaften
Magnesiumchlorid ist stark hygroskopisch. Seine Neigung zur Hydrolyse ist weniger ausgeprägt als beim Aluminiumchlorid (AlCl3). Wasserfreies Magnesiumchlorid kristallisiert im CdCl2-Gittertyp.
Magnesiumchlorid-Hexahydrat besitzt eine molare Masse von 203,3 g·mol–1, eine Dichte von 1,57 g·cm–3 und einen Schmelzpunkt von ca. 117 °C (Zersetzung).[1] Die Löslichkeit des Hexahydrates beträgt 1700 g/L (bei 20 °C).
Verwendung
Magnesiumchlorid wird zur Gewinnung von elementarem Magnesium mittels Schmelzflusselektrolyse genutzt:
Es wird zusammen mit Magnesiumoxid in Estrichzementen verwendet, als Streusalz und als Lebensmittelzusatzstoff mit der Kennzeichnung (E-Nummer) E 511. Es dient als künstlicher Geschmacksverstärker und ist für Öko-Lebensmittel zugelassen.
Des Weiteren wird Magnesiumchlorid zur Anhebung der Magnesiumkonzentration in Riffaquarien verwendet.
Es wird auch zur Staubbindung (Explosionsschutz) im Steinkohlebergbau verwendet.
Quellen
Wikimedia Foundation.