- Elbs-Reaktion
-
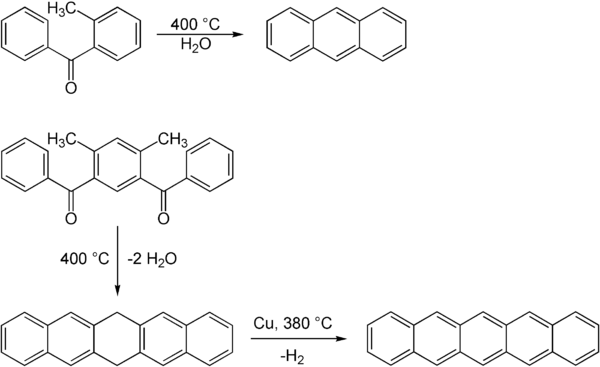
Die Elbs-Reaktion ist eine Namensreaktion aus dem Gebiet der Organischen Chemie. Es handelt sich um eine Pyrolyse in ortho-Position methylierter aromatischer Acyle zu einem kondensierten aromatischen System. Die Reaktion ist nach dem deutschen Chemiker Karl Elbs benannt, der außerdem die Elbs-Oxidation entwickelt hat. Die Reaktion wurde erstmals 1884 publiziert.[1][2] Elbs missinterpretierte jedoch das entstandene Produkt, was an der zu jener Zeit mangelnden Kenntnis über die Struktur von Anthracen begründet liegt.
Durchführung
Durch die Elbs-Reaktion können kondensierte aromatische Systeme erhalten werden. So ist, wie schon Elbs 1884 publizierte[1] Anthracen durch Dehydratisierung zugänglich. Auch größere aromatische Systeme, wie Pentacen, können auf diese Weise hergestellt werden. Die Reaktion läuft hier jedoch nicht in einem Schritt, sondern führt zu einem Dihydropentacen, das in einem weiteren Schritt mit Kupfer als Katalysator dehydriert werden muss.[3]
Die zur Synthese benötigten Acyle sind über eine Friedel-Crafts-Acylierung mit Aluminiumchlorid zugänglich.[2][3]
Varianten
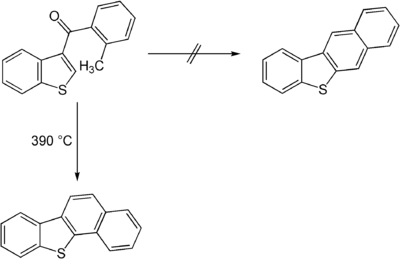
Auch mehrkernige heterocyclische Verbindungen können durch die Elbs-Reaktion synthetisiert werden. So wurde 1956 die Elbs-Reaktion eines Derivats des Thiophens publiziert. Hierbei wurde jedoch nicht das erwartete lineare System erhalten. Der Grund hierfür liegt in einem veränderten Reaktionsmechanismus, der nach Bildung eines Zwischenprodukts über mehrere radikalische Stufen verläuft.[4]
Quellen
- ↑ a b K. Elbs, E. Larsen: Ueber Paraxylylphenylketon, in: Ber. Dtsch. Chem. Ges. 1884, 17, 2847–2849; doi:10.1002/cber.188401702247.
- ↑ a b K. Elbs: Beiträge zur Kenntniss aromatischer Ketone. Erste Mittheilung, in: J. Prakt. Chem. 1886, 33, 180–188; doi:10.1002/prac.18860330119.
- ↑ a b E. Breitmaier, G. Jung: Organische Chemie, 5. Auflage, S. 183, Thieme Verlag, Stuttgart, 2005, ISBN 978-3-135-41505-5.
- ↑ G. M. Badger, B. J. Christie: Polynuclear heterocyclic systems. Part X. The elbs reaction with heterocyclic ketones, in: J. Chem. Soc. 1956, 3435–3437; doi:10.1039/JR9560003435.
Wikimedia Foundation.