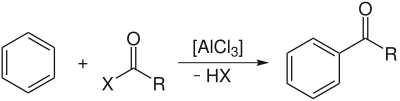- Friedel-Crafts-Acylierung
-
Unter der Friedel-Crafts-Acylierung (nach Charles Friedel und James Mason Crafts) versteht man die Einführung eines Acylrests (Acylierung) in ein aromatisches System durch eine elektrophile aromatische Substitution, meist mit Carbonsäurehalogeniden in Gegenwart meist stöchiometrischer Mengen[1] einer starken Lewis-Säure (z. B. FeCl3, BF3 oder AlCl3).
Inhaltsverzeichnis
Reaktionsgleichung
Die allgemeine Reaktionsgleichung der Friedel-Crafts-Acylierung lautet:
X repräsentiert dabei ein Halogenidrest, R ist in der Regel ein organischer Rest - damit resultiert aus der Reaktion ein Keton. Nur untergeordnete Bedeutung hat dagegen die Reaktion mit Formylfluorid, dem einzig stabilen Halogenid der Ameisensäure, bzw. einem Gasgemisch aus Kohlenstoffmonoxid und einer Halogenwasserstoffsäure wie HF oder HCl (Gattermann-Koch-Reaktion), die zu einem Aldehyd führt.
Reaktionsmechanismus
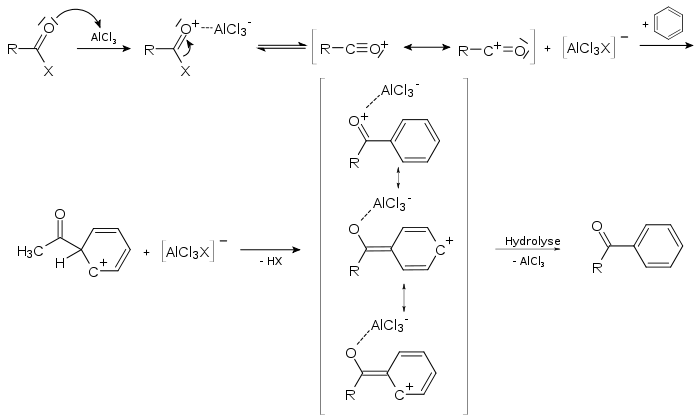
Die Friedel-Crafts-Acylierung wird dadurch eingeleitet, dass die Lewis-Säure an den Carbonylsauerstoff koordiniert und dadurch den Carbonylkohlenstoff noch weiter positiviert (2). Inwiefern der Komplex aus Acylhalogenid-Lewis-Säure 2 oder ein Acylium-Kation 3 das aktive Agens ist, hängt sowohl vom Substrat, dem Acylderivat als auch dem Lösungsmittel ab. Die Reaktion verläuft nun im Sinne einer elektrophilen aromatischen Substitution: es entsteht unter Aufhebung des aromatischen Charakters der σ-Komplex 4, der nach Abgabe eines Protons rearomatisiert das vorläufige Endprodukt 5 ergibt. Die Lewis-Säure ist weiterhin am Carbonylsauerstoff koordiniert. Dadurch braucht man für Friedel-Crafts-Acylierungen (im Gegensatz zur Friedel-Crafts-Alkylierung) mindestens stöchiometrische Mengen der Lewis-Säure. Deren Bezeichnung als Katalysator ist daher inkorrekt und wurde unkritisch von der Friedel-Crafts-Alkylierung übernommen. Die Hydrolyse im letzten Schritt setzt den acylierten Aromaten 6 frei. Als Lösungsmittel für die Reaktion dienen in der Regel die Aromaten im Überschuss selber. Es finden aber auch Nitrobenzol, Nitromethan oder bei tiefen Temperaturen Dichlormethan Verwendung.
Durch die häufig hohen sterischen Anforderungen des Acylhalogenid-Lewissäuren-Komplexes weist die Friedel-Crafts-Acylierung eine hohe Regioselektivität auf, was bei Umsetzung einfach substituierter Benzenderivate zum para-Produkt führt. Desaktivierend substitutierte Aromaten werden nach Friedel-Crafts nicht acyliert. Dementsprechend und wegen des deaktivierten Produktes 5 sind Mehrfach-Acylierungen bei dieser Reaktion nicht zu erwarten. Diese Eigenschaften machen die Friedel-Crafts-Acylierung synthetisch wertvoll gegenüber der Friedel-Crafts-Alkylierung.
Zur Darstellung aromatisch-aliphatischer Ketone ist die Friedel-Crafts-Acylierung die bevorzugte Methode.
Die Bedeutung der Reaktion wird durch die Tatsache, dass auch Carbonsäureanhydride und Carbonsäuren in Polyphosphorsäure geeignete Acylierungsmittel sind, noch größer. Durch die Aufeinanderfolge von Friedel-Crafts-Acylierung und Wolff-Kishner-Reduktion oder Clemmensen-Reduktion sind auch alkylsubstituierte Aromaten synthetisch zugänglich.
Neuere Entwicklungen
Es gibt neuere Varianten[2], welche auf den Edukteinsatz von Lewissäuren oder Protonensäuren verzichten und die Reaktion in Kontakt mit unterschiedlichen Feststoffen ablaufen lassen. Als besonderes vorteilhaft zeigte sich die Verwendung von Zinkoxid.[3] Mit sowohl aktivierten als auch (schwach) deaktivierten Arylen wie Chlorbenzol konnten bei milden Reaktionsbedingungen (Raumtemperatur) und kurzen Reaktionszeiten (einige Minuten) in vielen Fällen hohe Umsätze und Ausbeuten erzielt werden. Die Umsetzung wurde lösemittelfrei durchgeführt. Das Zinkoxid, welches unterstöchiometrisch einsetzbar ist, konnte wiedergewonnen und mehrfach eingesetzt werden. Es bedurfte keiner wässrigen Aufarbeitung, ein simpler nicht-protischer Auszug war ausreichend, um in den meisten Fällen ohne weitere Aufreinigung eine hohe Produktreinheit zu erzielen. Der Mechanismus wurde nicht untersucht. Es ist denkbar, dass intermediär Zinkchlorid als Lewissäure entsteht, allerdings läuft die Reaktion interessanterweise auch auf Graphit anstelle des Metalloxids ab.[4] Mit Säureanhydriden anstelle der Chloride versagte die Reaktion. Eine Reihe anderer Metalloxide, darunter Aluminiumoxid, zeigte sich als deutlich unterlegen oder unbrauchbar.
Einzelnachweise
- ↑ vgl. aber: D. E. Pearson, C. A Buehler: Friedel-Crafts acylations with little or no catalyst, in: Synthesis 1972, 10, 533–542; doi:10.1055/s-1972-21912.
- ↑ OC Portal.
- ↑ M. Hosseini Sarvari, H. Sharghi : Reactions on a Solid Surface. A Simple, Economical and Efficient Friedel-Crafts Acylation Reaction over Zinc Oxide as a New Catalys, J. Org. Chem. 2004, 69, 6953-6956.
- ↑ M. Kodomari, Y. Suzuki, K. Yoshida: Graphite as an effective catalyst for Friedel–Crafts acylation, Chem. Commun. 1997, 1567.
Siehe auch
- Friedel-Crafts-Alkylierung, Namensreaktionen, Reaktionsmechanismus
- Spezialfall: Gattermann-Koch-Synthese
Weblinks
Wikimedia Foundation.