- Eschenmoser-Fragmentierung
-
Unter der Eschenmoser-Fragmentierung, oft auch Eschenmoser-Ohloff- oder Eschenmoser-Tanabe-Fragmentierung versteht man eine organisch-chemische Reaktion zur Synthese von Alkinen und Ketonen aus α,β-ungesättigten Ketonen bzw. davon abgeleiteten α,β-Epoxyketonen. Sie ist nach ihrem Entdecker Albert Eschenmoser benannt und ging aus dessen Zusammenarbeit mit Firmenich-Forschern um Günther Ohloff bei der Synthese von Muscon und anderen makrocylischen Moschuskörpern hervor.[1][2]
Mechanismus
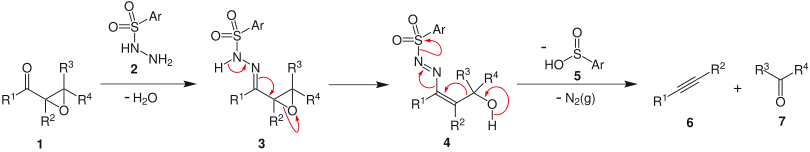
Die benötigten α,β-Epoxyketone werden gewöhnlich durch Weitz-Scheffer-Epoxidierung von α,β-ungesättigten Ketonen synthetisiert. Im ersten Schritt kondensiert ein Arylsulfonsäurehydrazid 2, zum Beispiel p-Toluolsulfonylhydrazid, mit dem Epoxyketon 1 unter Bildung des Sulfonylhydrazons 3. Der anschließende Fragmentierungs-Schritt kann dann säure- oder basenkatalysiert eingeleitet werden, wobei entweder der Epoxid-Sauerstoff protoniert, oder der Sulfonamid-Stickstoff deprotoniert wird. In beiden Fällen resultiert daraus der Alkohol 4. Typischerweise wird säurekatalysiert mit Eisessig in Dichlormethan bei –18°C gearbeitet. Unter Abspaltung von Stickstoff fragmentiert das Intermediat 4 zum Alkin 6 und dem Keton 7, sowie der Arylsulfinsäure 5 (Nebenprodukt). Triebkraft der Reaktion ist die Bildung molekularen Stickstoffs. Daneben gibt es auch eine radikalische Variante dieser α,β-Enon→Alkinon-Fragmentierung mit 1,2-Dibrom-5,5-dimethylhydantoin (DDH) in sek-Butanol, die ohne Epoxidierung auskommt und direkt vom α,β-ungesättigten Hydrazon ausgeht.[3] Dabei findet eine Allylbromierung mit DDH am Sulfonamid-Stickstoff, der capto-dativ-stabilisierten Radikalstelle statt, und das Bromid-Ion fungiert als Abgangsgruppe bei dem sich anschließenden nukleophilen Angiff eines Alkoholat-Ions. Diese Fehr-Ohloff-Büchi Variante der Eschenmoser-Ohloff Fragmentierung umgeht damit den Epoxidations-Schritt, der bei sterisch anspruchsvollen Substraten häufig zu schlechten Ausbeuten der klassischen Eschenmoser-Fragmentierung führt.
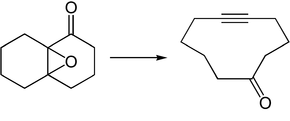
Durch die Verwendung bicyclischer Epoxyketone, die das Epoxid an beiden Brückenköpfen tragen, werden cyclische 1,6-Inone erhalten, was zur Synthese von Makrocyclen von Bedeutung ist.
Einzelnachweise
- ↑ J. Schreiber, D. Felix, A. Eschenmoser, M. Winter, F. Gautschi, K. H. Schulte-Elte, E. Sundt, G. Ohloff, J. Kalovoda, H. Kaufmann, P. Wieland, G. Anner, Helvetica Chimica Acta 1967, 50 , (7), 2101-2108.
- ↑ D. Felix, J. Schreiber, G. Ohloff, A. Eschenmoser, Helvetica Chimica Acta 1971, 54, (8), 2896-2912.
- ↑ C. Fehr, G. Ohloff, G. Büchi, Helvetica Chimica Acta 1979, 62, 2655-2660.
Weblinks
Wikimedia Foundation.