- Exzessenthalpie
-
Die Mischungswärme hE (auch als Mischungsenthalpie oder Exzessenthalpie bezeichnet) ist die Wärme, die beim Mischen von reinen chemischen Stoffen entweder entsteht (exothermer Verlauf) oder aufgenommen (endothermer Verlauf) wird.
Inhaltsverzeichnis
Beispiele
Stark exotherm verläuft das Mischen der Komponenten Chloroform und Tetrahydrofuran mit etwa -2800 J/mol. Das Mischen von Ethanol und Chloroform verläuft je nach gewählter Quell-Stoffmenge entweder exotherm (bspw. 20 mol-% Chloroform und 80 mol-% Ethanol mit etwa -400 J/mol) oder endotherm (bspw. 20 mol-% Ethanol und 80 mol-% Chloroform mit etwa +700 J/mol). Chloroform und Cyclohexan sind ein Beispiel für endothermes Mischen mit etwa +700 J/mol). Alle Beispielangaben gelten für ca. 25°C.
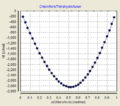
Mischungsenthalpien bei T=25°C Modellierung
Mischungswärmekurven[1] binärer Mischungen bei einer gegebenen Temperatur können mit den Gleichungen nach Redlich-Kister (RK) [2] und einer Summe symmetrischer Funktionen (SSF) beschrieben werden. Beide Gleichungen sind Reihenentwicklungen, die auf der Beziehung
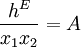
basieren (x1, x2: Molenbrüche der beiden Komponenten, A: Konstante). Diese einfache Beziehung ist jedoch nur für wenige Systeme ausreichend genau.
Redlich-Kister
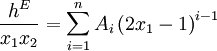
Ai: anpassbarer Parameter.
n=1..6 (ein bis sechs Parameter).Summe symmetrischer Funktionen
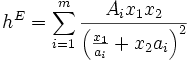
Ai, ai: anpassbare Parameter.
m=1..3 (zwei, vier oder sechs Parameter).Literatur
- ↑ Christensen C., Gmehling J., Rassmussen P., Weidlich U., Holderbaum T., "Heats of Mixing Data Collection", DECHEMA Chemistry Data Series Vol. III., DECHEMA, Frankfurt/M., 1984-1991
- ↑ Redlich O., Kister A.T., "Algebraic Representation of Thermodynamic Properties and the Classification of Solutions", Ind.Eng.Chem., 40(2), 345-348, 1948
Siehe auch
Die Dortmunder Datenbank enthält auch Mischungswärmen.
Wikimedia Foundation.