- FMOC-Schutzgruppe
-
Fluorenylmethoxycarbonyl (Fmoc) ist eine Schutzgruppe, die zum Schützen von Aminen verwendet wird. Ein Einsatzgebiet ist die Synthese von Peptiden. Mit dieser Schutzgruppe ist es möglich, die nächste Aminosäure im Kettenwachstum in Richtung des N-terminalen Endes des Peptids zu schützen. Die Kombination aus N-Fmoc und tert-Butylestern bzw. seinen chemisch verwandten polymergebundenen Analoga ist eine ideale orthogonale Schutzgruppen-Kombination und findet breite Anwendung in der Festphasen-Peptid-Synthese.
Inhaltsverzeichnis
Bedeutung
Die Fluorenylmethoxycarbonyl-Gruppe bildet ein zentrales Element in der Strategie der Festphasen-Peptidsynthese. Idealerweise sollten sich in einer automatisierbaren Synthese, wie der genannten, alle nötigen Schutzgruppen getrennt und ungestört von einander entfernen lassen können. Dieses Konzept nennt man Orthogonalität der Schutzgruppen.
In der Peptidsynthese hat man es in der Regel mit drei Gruppen von Schutzgruppen zu tun. Die Schutzgruppe in der Richtung das zukünftige N-terminale Ende also eine Schutzgruppe. Das C-terminale Ende ist auf dem Harz gebunden welches in gewisser Weise selber eine Art Schutzgruppe darstellt denn ein verfrühtes Ablösen des wachsenden Peptides würde die Ausbeuten erheblich senken. Die dritte Art sind die Schutzgruppen für die eventuell vorhandenen störenden funktionellen Gruppen in den Aminosäuren die in das Peptid eingebaut werden sollen.
Hier stellt Fmoc durch seine außergewöhnliche Eigenschaft im sauren stabil zu sein aber dagegen im basischen labil zu sein eine Ausnahme unter den Schutzgruppen dar denn die meisten werden unter sauren Bedingungen gespalten.
In der Festphasen-Peptid-Synthese werden Peptide an Harzen nach Merrifield und Weiterentwicklungen dieser Technik automatisiert mit Hilfe von Syntheserobotern herzustellen. Die dabei angewandten Standardprotokolle ermöglichen Peptidkupplung in Ausbeuten von über 99.99% was nötig ist um Peptide im 10 kDa-Bereich synthetisieren und später aufreinigen zu können.
Entschützen
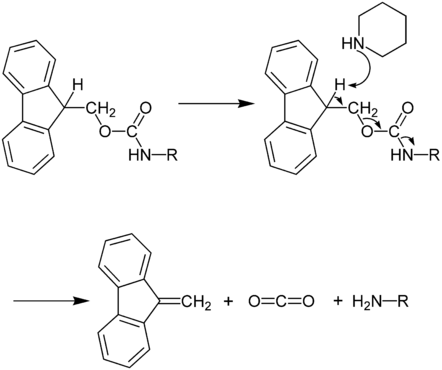
Die Schutzgruppe kann unter schwach basischen Bedingungen wieder entfernt werden, ist jedoch unter sauren Bedingungen stabil. Daher kann sie gut in Verbindung mit der sogenannten BOC-Schutzgruppe (tert-Butylcarbamat) und der in diesem Zusammenhang gebräuchlichen Schutzgruppe für Carbonsäuren dem tert.-Butylester eingesetzt werden und ist orthogonal dazu weil die BOC- und auch die tert-Butylester-Gruppe sauer (normalerweise mit konzentrierter Trifluoressigsäure) entfernt wird. Beim Entschützen von Fmoc wird das saure Wasserstoff-Atom mit Hilfe einer Base (meist ein sekundäres Amin) entfernt. Dadurch kollabiert das Schutzgruppensystem zu einem quasi-aromatischen System und dem freien Amin (z. B. Ester eines Peptides) , wie im Reaktionsmechanismus gezeigt:
Das Proton in der 9-Position des Fluorenyl-Ringes (pKa = 22.6 in DMSO) kann unter verhältmässig milden Bedingungen entfernt werden. Dadurch ist es möglich, dass die Entschützung mit 10% Piperidin, einer relativ schwachen Base, in Dimethylformamid (DMF) innerhalb weniger Minuten (30 min) erfolgen kann. Aufgrund charakteristischen UV-Absorptionen bei 301 nm (ε=7800) kann man den korrekten Verlauf der Entschützung verfolgen und dadurch bei Peptidsynthesen mittels eines Synthesisers problematische Peptidkupplungen anhand der langsamen oder schlechten Abspaltung der Schutzguppe erkennen.Schutz der Aminofunktion
Normalerweise erfolgt der Schutz der Aminofunktion, bei Abwesenheit von anderen störenden Gruppen seitens der Aminosäure, durch die Umsetzung mit Fluorenylmethoxycarbonylchlorid (Fmoc-Cl) oder N-(9-Fluorenylmethoxycarbonyloxy)-succinimid (Fmoc-OSu) in Gegenwart einer wässrigen Natriumhydrogencarbonatlösung mit der entsprechenden Aminosäure. Die Fmoc-Derivate aller gängigen Aminosäuren sind kommerziell erhältlich.
Literatur
W. Chan (Autor), W. C. Chan (Herausgeber), Peter D. White. In: Fmoc Solid Phase Peptide Synthesis: A Practical Approach (Taschenbuch), Oxford University Press Oxford New York 2000, ISBN 0-19-963724-5
Wikimedia Foundation.