- Fluor-Antimonsäure
-
Strukturformel 
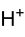
Allgemeines Name Fluor-Antimonsäure Summenformel HSbF6 CAS-Nummer 16950-06-4 Kurzbeschreibung farblose Flüssigkeit[1]
Eigenschaften Molare Masse 236,8 g·mol−1 Aggregatzustand flüssig
Dichte 2,89 g·cm−3[1]
Dampfdruck Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [1] 

Achtung
H- und P-Sätze H: 302-332-411 EUH: keine EUH-Sätze P: 273 [1] EU-Gefahrstoffkennzeichnung [1] 

Umwelt-
gefährlichGesundheits-
schädlich(N) (Xn) R- und S-Sätze R: 20/22-51/53 S: 61 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Fluor-Antimonsäure, die zu den Supersäuren gezählt wird, ist eine der stärksten bekannten Säuren. Sie ist eine Mischung der sehr starken Lewis-Säure Antimon(V)-fluorid und der mittelstarken Brønsted-Säure Fluorwasserstoff in unterschiedlichen Anteilen. Da man die Säurestärke nicht mehr direkt messen kann, wird sie über die Hammettsche Aciditätsfunktion bestimmt. Dabei hat eine Mischung, bei der SbF5 und HF im Verhältnis 1:200 vorliegen, einen H0-Wert von etwa −21[2]. Bei größeren Mengen an HF steigt der H0-Wert weiter bis hin zum Maximalwert von −31,3 an, der bei einem Mischungsverhältnis von 1:1 vorliegt. (Zum Vergleich: reine Schwefelsäure besitzt einen H0-Wert von −11,9 und ist damit mehrere Trillionen Mal schwächer sauer!).
Auf Grund ihrer Stärke kann Fluor-Antimonsäure wie die ähnliche magische Säure sehr viele Stoffe, insbesondere Kohlenwasserstoffe, protonieren. Dadurch werden sie in kleinere Moleküle gespalten und sind dann in vielen organischen Lösungsmitteln löslich.

- Reaktion von Fluorwasserstoff und Antimon(V)-fluorid zur Fluor-Antimonsäure
Einzelnachweise
Kategorien:- Gesundheitsschädlicher Stoff
- Umweltgefährlicher Stoff
- Chemische Lösung
- Antimonverbindung
- Fluorverbindung
- Supersäure
Wikimedia Foundation.
