- SbF5
-
Strukturformel 
Allgemeines Name Antimon(V)-fluorid Andere Namen Antimonpentafluorid
Summenformel SbF5 CAS-Nummer 7783-70-2 Kurzbeschreibung farblose viskose Flüssigkeit Eigenschaften Molare Masse 216,74 g·mol−1 Aggregatzustand flüssig
Dichte Schmelzpunkt Siedepunkt 149–150 °C[1]
Dampfdruck 13 mbar (25 °C)[2]
Löslichkeit heftige Reaktion mit Wasser[1]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 

Gesundheits-
schädlichUmwelt-
gefährlich(Xn) (N) R- und S-Sätze R: 20/22-51/53 S: (2)-61 MAK aufgehoben, da cancerogen[2]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Antimonpentafluorid ist ein farbloses Öl bestehend aus den Elementen Antimon und Fluor. Es besitzt die chemische Formel SbF5.
Inhaltsverzeichnis
Gewinnung und Darstellung
Antimonpentafluorid wird durch Reaktion von Antimon(III)-fluorid mit Fluor hergestellt.
Eigenschaften
Physikalische Eigenschaften
In der Gasphase liegen die Moleküle einzeln in trigonal-bipyramidaler Struktur vor. In der flüssigen Phase liegt das Antimonpentafluorid jedoch als Kettenpolymer mit der Summenformel (SbF5)n (n meist zwischen 5 und 10) vor.
Bis zu einer Temperatur von 152 °C liegt Antimonpentafluorid als Trimer vor, bis 252 °C als Dimer, darüber als Monomer.In der festen Phase bildet Antimonpentafluorid cyclische Tetramere.
Chemische Eigenschaften
Antimonpentafluorid ist eine sehr starke Lewis-Säure und ein starker F--Akzeptor. Infolgedessen existieren diverse Addukte (zum Beispiel SbF5·SO2, SbF5·NO2) und Komplexe (Beispielsweise MF·SbF5 = M+SbF6-).
Antimonpentafluorid ist in der Lage, die Oxidationskraft von Fluor zu verstärken, so dass dieses in der Lage ist, Sauerstoff zu oxidieren.[4]
Antimon(V)-fluorid greift Glas an, verhält sich gegen Kupfer und Blei aber nur leicht korrosiv. Quartz, Platin und Aluminium werden nicht angegriffen.[5]
Verwendung
Aufgrund seiner starke Lewis-Acidität lassen sich aus Antimonpentafluorid in Kombination mit starken Brønstedt-Säuren sogenannte Supersäuren herstellen. Bekannt ist die „Magische Säure“ (Magic Acid), welche aus Antimonpentafluorid und Fluorsulfonsäure besteht. Das sauerste, bisher bekannte Gemisch beider Stoffe besteht aus Fluorsulfonsäure mit 25 mol% Antimonpentafluorid und erreicht einen H0-Wert von −21,5. Es ist somit rund 1010 mal stärker als reine Schwefelsäure. Sie ist in der Lage, Paraffine zu zersetzen und sehr schwache Basen, wie beispielsweise CH4 zu CH5+, zu protonieren. Ebenso vermag dies die Fluor-Antimonsäure, ein Gemisch aus Antimonpentafluorid und Fluorwasserstoff im Mischungsverhältnis 1:1. Sie hat einen H0-Wert von −31,3 und ist somit rund 2×1019 mal stärker als reine Schwefelsäure.
Sicherheitshinweise
Aufgrund der hohen Reaktivität sollte Antimonpentafluorid sehr sorgfältig gehandhabt werden. Ungewollter Kontakt mit anderen Stoffen, besonders mit Feuchtigkeit, sollte in jedem Fall vermieden werden. Als Zersetzungsprodukte können Fluorwasserstoff und Stiban entstehen.
Der LD50-Wert (Maus, inhalativ) liegt bei 270 mg/m3.
Quellen
- A.F. Holleman, E. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin/New York 1995. ISBN 3-11-012641-9.
- Autorenteam: RÖMPP CD 2006. Georg Thieme Verlag, Stuttgart/New York 2006. ISBN 3-131-43321-3.
- ↑ a b c d Sicherheitsdatenblatt (Merck)
- ↑ a b Eintrag zu Antimon(V)-fluorid in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 23.12.2007 (JavaScript erforderlich)
- ↑ Nicht explizit in RL 67/548/EWG, Anh. I gelistet, fällt aber dort mit der angegebenen Kennzeichnung unter den Sammelbegriff „Antimonverbindungen“; Eintrag in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 31. März 2009 (JavaScript erforderlich)
- ↑ Shamir J., Binenboym J.: Dioxygenyl Salts. Inorganic Syntheses, 1973, XIV, 109-122. ISBN 0-07-071320-0.
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 200.
Wikimedia Foundation.

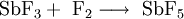

}](/pictures/dewiki/100/d203bc8f940c9b5f5f4da168da2418fc.png)