- Fries-Umlagerung
-
Bei der Fries-Umlagerung oder -Verschiebung werden Arylester (beispielsweise Phenylester) unter Lewis-Säure-Katalyse in entsprechende Arylketone umgelagert. Die Reaktion ist nach ihrem Entdecker, dem deutschen Chemiker Karl Fries (1875−1962) benannt.[1]
Inhaltsverzeichnis
Mechanismus
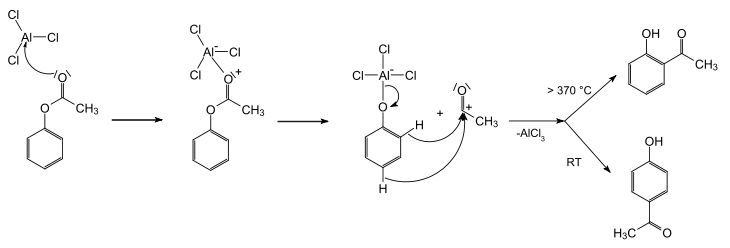
Trotz erheblicher Anstrengungen konnten noch keine abschließenden Aussagen zum Mechanismus gesichert werden. So wurden in Kreuzexperimenten sowohl Hinweise für intra- als auch intermolekulare Abläufe gefunden. Der Ablauf der Reaktion ist sowohl vom Lösemittel als auch dem Substrat abhängig. Allgemein jedoch wird der untenstehende Mechanismus als bislang beste Erklärung akzeptiert. In einem ersten Schritt greift die Lewis-Säure (hier Aluminiumchlorid, AlCl3) an dem Carbonylsauerstoff der Acylgruppe an. Dieser ist stärker negativiert als der phenolische Sauerstoff und somit bevorzugtes Ziel. Dadurch wird die Bindung des Acylrestes zum phenolischen Sauerstoff polarisiert. Dann wandert das Aluminiumchlorid zum phenolischen Sauerstoff. Dabei wird durch Verschiebung der Bindungselektronen ein Acylium-Kation freigesetzt. Dieses Acylium-Kation reagiert nun unter klassischer elektrophiler Aromatensubstitution (SE-Ar, hier nicht wiedergegeben) mit dem Aromaten. Das dabei abgespaltene Proton wird in Form von Chlorwasserstoff (das Chlorid stammt aus dem Aluminiumchlorid) freigesetzt. Das entstandene Hydroxyketon bleibt als Anion an das Aluminium gebunden; die Aluminiumverbindung wird anschließend durch Zugabe von Wasser hydrolysiert.
Die Orientierung der Substitution ist temperaturabhängig. Bei niedriger Temperatur wird bevorzugt das para-Produkt, bei hoher Temperatur das ortho-Produkt gebildet.
Bedeutung
Da die Reaktion von Phenolen mit Acylhalogeniden unter den Bedingungen der Friedel-Crafts-Acylierung Phenylester, nicht aber die gewünschten Hydroxyarylketone liefert, ist die Reaktion von großtechnischer Bedeutung für die Synthese der Hydroxyarylketone die als wichtige Ausgangsstoffe für die Synthese verschiedener Pharmazeutika (z.B. Paracetamol oder Salbutamol) dienen. Anstelle des Aluminiumchlorids können zum Teil auch andere Lewissäuren (Bortrifluorid, Bismuttriflat etc.) oder auch starke protische Säuren (Flusssäure oder Methansulfonsäure) zum Einsatz kommen. Um den Verbrauch dieser korrosiven und ökologisch bedenklichen Katalysatoren zu vermeiden, wird intensiv der Einsatz von Festkörperkatalysatoren untersucht.
Grenzen
In allen Fällen können nur solche Ester verwendet werden deren Acylkomponente unter den harschen Bedingungen stabil ist. Ist der Aromat oder die Acylkomponente hochsubstituiert, sinkt aufgrund zu starker sterischer Beanspruchung die Ausbeute stark ab. Deaktivierende (meta-dirigierende) Gruppen am Aromaten lassen die Ausbeuten drastisch absinken, wie für eine Friedel-Crafts-Reaktion zu erwarten ist.
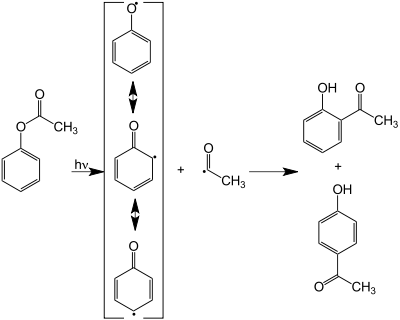
Photo-Fries-Umlagerung
Neben der oben beschriebenen Reaktion der Phenylester existiert eine als Photo-Fries-Unlagerung bezeichnete Variante, die über einen radikalischen Mechanismus verläuft. Sie kann auch bei Anwesenheit deaktivierender Gruppen am Aromaten genutzt werden, wird aber aufgrund der in der Regel schlechten Ausbeuten bislang nur im Labor eingesetzt. Wenn die para-Position am Phenylrest durch einen Substituenten (z. B. eine Methylgruppe) blockiert ist, entstehen nur ortho-Hydroxyketone.[2] Ist der Phenylrest in para-Position nicht substituiert, entstehen Gemische der ortho- und para-Hydroxyketone.[3]
Literatur
- K. Fries, G. Finck: "Über Homologe des Cumaranons und ihre Abkömmlinge", in: Berichte der deutschen chemischen Gesellschaft 1908, 41 (3), 4271–4284; doi:10.1002/cber.190804103147.
- K. Fries, G. Finck: "Über Sauerstoff-Isologe homologer Indirubine", in: Berichte der deutschen chemischen Gesellschaft 1908, 41 (3), 4284–4294; doi:10.1002/cber.190804103146.
- K. Fries, W. Pfaffendorf: "Über ein Kondensationsprodukt des Cumaranons und seine Umwandlung in Oxindirubin", in: Berichte der deutschen chemischen Gesellschaft 1910, 43 (1), 212–219; doi:10.1002/cber.19100430131.
- Jerry March: „Advanced Organic Chemistry“, 3rd Ed., John Wiley & Sons 1985, ISBN 0-471-88841-9, S. 499–500.
Einzelnachweise
- ↑ Louis Fieser, Mary Fieser: Organische Chemie, Verlag Chemie Weinheim, 2. Auflage, 1972, S. 926−928, ISBN 3-527-25075-1.
- ↑ Jürgen Martens und Klaus Praefcke: Organische Schwefelverbindungen VII : Photochemische α-Spaltung von Thiobenzoesäure-S-p-tolylestern in Lösung, Chem. Ber. 107 (1974) 2319−2325, doi:10.1002/cber.19741070716.
- ↑ Louis Fieser, Mary Fieser: Organische Chemie, Verlag Chemie Weinheim, 2. Auflage, 1972, S. 928−929, ISBN 3-527-25075-1.
Weblinks
Fries Rearrangement. www.organic-chemistry.org. Abgerufen am 9. März 2009.
Wikimedia Foundation.