- Paracetamol
-
Strukturformel 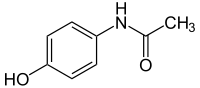
Allgemeines Freiname Paracetamol Andere Namen Summenformel C8H9NO2 CAS-Nummer 103-90-2 PubChem 1983 ATC-Code N02BE01
DrugBank DB00316 Kurzbeschreibung Arzneistoffangaben Wirkstoffklasse Wirkmechanismus Hemmung der Cyclooxygenase-2 (COX-2) im Rückenmark[3]
Verschreibungspflichtig: teilweise Eigenschaften Molare Masse 151,16 g·mol−1 Dichte 1,29 g·cm−3 (21 °C)[1]
Schmelzpunkt - 169 °C (polymorphe Form I)[4]
- 159 °C (polymorphe Form II)[5]
Siedepunkt > 500 °C, ab 180 °C thermische Zersetzung[1]
pKs-Wert 9,38[6]
Löslichkeit Sicherheitshinweise Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln GHS-Gefahrstoffkennzeichnung [7] 
Achtung
H- und P-Sätze H: 302-315-319-335 EUH: keine EUH-Sätze P: 261-305+351+338 [7] EU-Gefahrstoffkennzeichnung [1]
Xn
Gesundheits-
schädlichR- und S-Sätze R: 22-36/38-52/53 S: 26-37/39-61 MAK 10 mg·m−3[1]
LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Paracetamol ist ein schmerzstillender und fiebersenkender Arzneistoff aus der Gruppe der Nichtopioid-Analgetika.
Die Bezeichnungen Paracetamol leitet sich vom chemischen Namen Para-(Acetylamino)phenol ab. Paracetamol wird im Rahmen der Selbstmedikation als Monopräparat oder Bestandteil verschiedener Kombinationspräparate zur symptomatischen Behandlung von Erkältungsbeschwerden und Schmerzen eingesetzt. Seit ihrer Einführung in den 1950er Jahren, fast 70 Jahre nach der erstmaligen Herstellung dieses Wirkstoffs durch Harmon Northrop Morse, zählen Arzneimittel mit Paracetamol – neben jenen, die Acetylsalicylsäure oder Ibuprofen enthalten – weltweit zu den gebräuchlichsten Schmerzmitteln. Seit 1977 steht Paracetamol auf der Liste der unentbehrlichen Arzneimittel der WHO.
In Nordamerika ist die übliche Bezeichnung der Substanz Acetaminophen, abgeleitet aus der englischen Bezeichnung des Wirkstoffes Para-(Acetylamino)phenol.
Inhaltsverzeichnis
Geschichte
Die Herstellung von Paracetamol als Produkt der Reduktion von p-Nitrophenol mit Zink in Eisessig (konzentrierte Essigsäure) wurde erstmals 1878 von Harmon Northrop Morse beschrieben.[8] Josef von Mering verwendete 1887 Paracetamol erstmalig in der Heilkunde, jedoch erweckte die Anwendung wenig Aufsehen.[9] Deutlich mehr an therapeutischer Bedeutung gewannen in den folgenden Jahren zwei dem Paracetamol nahe verwandte Substanzen, das Acetanilid und das Phenacetin.
1893 wurde Paracetamol erstmals im Urin eines Menschen nachgewiesen, der Phenacetin zu sich genommen hatte. 1899 wurde das Paracetamol außerdem als Stoffwechselprodukt (Metabolit) des Acetanilids erkannt – diese Entdeckungen blieben jedoch ohne Resonanz, so dass Paracetamol weiterhin keine Anwendung in der Medizin fand.
Erst nach dem Zweiten Weltkrieg wurde das Paracetamol bekannter, als es 1948 von Bernard Brodie und Julius Axelrod am New York City Department of Health ein zweites Mal als Metabolit von Phenacetin identifiziert wurde. Diese forschten im Regierungsauftrag nach neuen Schmerzmitteln und zeigten in ihrer Arbeit auf, dass der schmerzstillende Effekt des Acetanilids und des Phenacetins vollständig auf das Abbauprodukt dieser Stoffe, das Paracetamol, zurückzuführen ist. Sie regten an, diesen Stoff in seiner Reinform zu nutzen, um die toxischen Nebenwirkungen der Ursprungsstoffe zu vermeiden.
Seinen ersten Einsatz in einem Fertigarzneimittel fand Paracetamol 1955 in den USA in Tylenol® Children's Elixir der Firma McNeil Laboratories.[10] Seit 1956 ist Paracetamol in Tablettenform mit 500 mg Wirkstoff erhältlich und wurde in Großbritannien unter dem Markennamen Panadol® verkauft, hergestellt von der Firma Frederick Stearns & Co, die ein Ableger der Sterling Drug Inc. war. Es war ausschließlich auf Rezept zu bekommen und wurde als schmerzstillendes und fiebersenkendes Mittel beworben, welches zugleich den Magen schone. Die damals bereits bekannte Acetylsalicylsäure ist weniger magenfreundlich. 1958 kam zusätzlich eine Kinderversion des Präparates mit dem Namen Panadol Elixir® auf den Markt. 1959 wurde Paracetamol vom Münchener Unternehmen bene-Arzneimittel als erstes Monopräparat unter dem Markennamen ben-u-ron® auf dem deutschen Markt eingeführt.[11][12]
Seit 1963 wird Paracetamol im britischen Arzneibuch, der „British Pharmacopoeia“, monographiert. Kurz danach wurde es auch in Arzneibücher anderer europäischer Staaten aufgenommen.
1982 kam es in den USA zu einem Fall von Produktsabotage,[13][14] durch dessen Folgen sich die zuständige Staatsbehörde Food and Drug Administration veranlasst sah, strengere Schutzvorschriften zu erlassen. Durch vergiftete Paracetamolpräparate waren sieben Patienten gestorben. Zurückgerufen wurden Präparate im Marktwert von 100 Millionen US-Dollar.
Anwendung
Anwendungsgebiete (Indikationen)
Paracetamol ist als Fertigarzneimittel zur Behandlung leichter bis mäßig starker Schmerzen und des Fiebers zugelassen.[15] Verwendung findet es vor allem bei leichten Kopfschmerzen, leichten Zahnschmerzen, Regelschmerzen,[15] Sonnenbrand und arthrosebedingten Gelenkschmerzen sowie bei Migräne.
Ebenfalls zur Behandlung leichter bis mäßiger Schmerzen ist Paracetamol in fixer Kombination mit Coffein (400 mg Paracetamol, 50 mg Coffein) zugelassen. Diese Kombination soll eine um das 1,3- bis 1,7-fach höhere Wirkstärke als Paracetamol allein haben und ermöglicht die Reduktion der Paracetamoldosis. Coffein verkürzt zudem die Zeit bis zum Wirkungseintritt von Paracetamol.[16] Auch die Dreifachkombination von Paracetamol mit Acetylsalicylsäure und Coffein führt zu einer gesteigerten Wirksamkeit[17] und wird daher von der Deutschen Migräne- und Kopfschmerz-Gesellschaft als Mittel der ersten Wahl zur Behandlung der Migräne und des Spannungskopfschmerzes empfohlen.[18][19]
In fixer Kombination mit Codein (Co-Codamol) oder Tramadol ist Paracetamol zur Behandlung mäßig starker bis starker Schmerzen zugelassen.[20]
Da Erkältungskrankheiten mit Fieber, Glieder- und Kopfschmerzen einhergehen können, ist Paracetamol in Kombination mit weiteren Arzneistoffen wie Antihistaminika, Hustenlöser, Hustenblockern oder Vitamin C als analgetisch und antipyretisch wirksamer Bestandteil vieler sogenannter „Grippemittel“ bzw. „Erkältungsmittel“ zugelassen.
Gegenanzeigen (Kontraindikationen) und Warnhinweise
Bei einer bekannten Überempfindlichkeit gegen Paracetamol oder bei einer schweren Beeinträchtigung der Leberfunktion auf Grund eines Leberversagens mit einem Child-Pugh-Score von 9 oder höher darf Paracetamol nicht angewendet werden. Bei Patienten mit Leberversagen mit einem Child-Pugh-Score von < 9, einem Gilbert-Syndrom, chronischem Nierenversagen mit einer Kreatinin-Clearance von unter 10 ml/min oder einem chronischen Alkoholmissbrauch darf Paracetamol nur mit besonderer Vorsicht unter ärztlicher Kontrolle und gegebenenfalls einer angepassten Dosierung angewendet werden.[15]
Bei längerer hochdosierter, nicht bestimmungsgemäßer Anwendung von Paracetamol ist die Entstehung eines medikamenteninduzierten Kopfschmerzes möglich. Nach abruptem Absetzen verschlimmern sich die Kopfschmerz- und Begleitsymptome.[15]
Schwangerschaft und Stillzeit
Zumeist ältere Reproduktionsstudien und epidemiologische Daten gaben keinen Hinweis auf eine schädigende Wirkung von Paracetamol auf die Gesundheit des Fetus bzw. des Neugeborenen. Neuere Untersuchungen legen einen möglichen Zusammenhang zwischen der Einnahme von Paracetamol während der Schwangerschaft und einem gehäuften Auftreten von Asthma beim Kind nahe.[21][22][23] Für eine Langzeitanwendung während der Schwangerschaft liegen keine ausreichenden Daten zur Abschätzung der Sicherheit vor.[15]
Wenngleich Paracetamol in geringen Mengen in die Muttermilch übergeht, sind bei Einnahme von Paracetamol während der Stillzeit keine unerwünschten Wirkungen für den Säugling bekannt geworden.[15]
Art der Anwendung und Dosierung
Paracetamol kann oral, rektal oder intravenös verabreicht werden. Paracetamol wird in Abhängigkeit von Alter und Körpergewicht dosiert. Bei einer oralen Anwendung werden in der Regel 10–15 mg Paracetamol pro kg Körpergewicht als Einzeldosis und bis 60 mg/kg Körpergewicht als Tagesgesamtdosis verwendet. Dies entspricht bei Erwachsenen einer maximalen Tagesdosis von 4000 mg verteilt auf vier Einzeldosen. Eine Dosisanpassung wird bei Patienten mit einer Nieren- oder Leberfunktionsstörung vorgenommen.[15]
Wechselwirkungen
Probenecid hemmt die Glucuronidierung von Paracetamol und somit seine Ausscheidung. Eine Hemmung der Ausscheidung von Paracetamol kann ebenfalls nach gleichzeitiger Einnahme von Salicylamiden beobachtet werden. Alkohol und Arzneimittel, die als Induktoren des Cytochrom-P450-Enzymsystems wirken, wie beispielsweise Carbamazepin und Barbiturate, führen zu einer verstärkten Bildung von leberschädlichen Stoffwechselprodukten (Metaboliten) des Paracetamols. Ionenaustauscher, wie beispielsweise Colestyramin, reduzieren die Aufnahme von Paracetamol. Der Eintritt der Wirkung von Paracetamol kann durch Arzneimittel, die die Magen-Darm-Tätigkeit beeinflussen, wie beispielsweise Metoclopramid, verlangsamt oder beschleunigt werden.
Paracetamol selbst beeinflusst nur in seltenen Fällen die Wirkung anderer Arzneimittel. Bei regelmäßiger Einnahme verstärkt Paracetamol die Wirkung von Gerinnungshemmern wie Phenprocoumon und Warfarin. Auch die blutbildschädigenden Nebenwirkungen von Zidovudin können bei gleichzeitiger Einnahme von Paracetamol verstärkt werden.[15] Weiterhin mehren sich in letzter Zeit die Hinweise, dass Paracetamol und bestimmte andere Schmerzmittel aus der Gruppe der nichtsteroidalen Antiphlogistika bzw. Nichtsteroidale Antirheumatika (NSAIDs), wie z. B. Acetylsalicylsäure (Aspirin) die Wirksamkeit von Impfstoffen herabsetzen können, indem der Körper nach einer Impfung weniger der schützenden Antikörper bildet.[24][25][26][27][28] Letzteres wird darauf zurückgeführt, dass durch Medikamente wie Paracetamol die terminale Differenzierung der B-Zellen zu Antikörper-produzierenden Plasmazellen beeinträchtigt wird.[29] Forscher und Ärzte raten daher, einige Zeit vor und nach der Impfung auf entsprechende Medikamente zu verzichten.[30][31][32]
Nebenwirkungen
Paracetamol zeigt bei bestimmungsgemäßem Gebrauch nur selten bis sehr selten unerwünschte Wirkungen. Keine der auf eine Einnahme von Paracetamol zurückzuführenden Nebenwirkungen tritt häufiger als bei einem unter 1000 Patienten auf. Dazu gehören der Anstieg bestimmter Leberenzyme (Transaminasen) im Serum (Häufigkeit: 0,01–0,1 %). Sehr selten (Häufigkeit: < 0,01 %) bzw. in Einzelfällen konnten schwerwiegende Veränderungen des Blutbildes wie Thrombozytopenie (verringerte Anzahl von Blutplättchen) und Agranulozytose beobachtet werden. Ebenso selten kann es zu allergischen Reaktionen in Form von einfachem Hautausschlag oder Nesselausschlag bis hin zu einer Schockreaktion kommen. Ebenfalls mit einer Häufigkeit von unter 0,01 % kam es bei empfindlichen Personen zu einer Verkrampfung der Atemmuskulatur (Analgetika-Asthma).[15] Bei bestimmungsgemäßer Anwendung von Paracetamol ist das Risiko einer Analgetika-Nephropathie sehr gering. Ob dieses Risiko durch eine kombinierte Anwendung mit Acetylsalicylsäure und Coffein erhöht ist, wird kontrovers diskutiert.[33]
Epidemiologische Studien bringen den Paracetamolkonsum in der Kindheit dosisabhängig mit einem langfristig erhöhten Asthmarisiko und einem erhöhten Risiko für das Auftreten von Entzündungen der Nasenschleimhaut und der Augenbindehaut (Allergische Rhinitis) sowie Hautentzündungen (Ekzem) in Verbindung.[34][35] Andere Studien widersprechen der These, dass Paracetamol Asthma fördert [36]
Der Abbau von Paracetamol verbraucht Glutathion und kann bei älteren Patienten zu einem Mangel an schwefelhaltigen Aminosäuren führen, was generell auf Dauer über den Glutathionmangel zu kardiovaskulärer Anfälligkeit führen kann.[37]
Missbrauch und Überdosierung
Paracetamolüberdosierungen als Folge der Unkenntnis der maximalen Tagesdosis, Nichtbeachtung von Gegenanzeigen und Anwendungsbeschränkungen sowie in selbstschädigender, meist suizidaler Absicht sind häufig mit schweren Beeinträchtigungen der Leberfunktion verbunden.[38] Eine Überdosierung über 150 Milligramm pro Kilogramm Körpergewicht, entsprechend 10 Gramm für Erwachsene, kann zu einer irreversiblen Schädigung der Leberzellen oder gar zum Leberversagen führen. Alkoholiker oder Patienten mit einer verringerten Ausscheidung von Paracetamol können schon bei einer deutlich geringeren Dosis Leberschäden erleiden.[39][40] In England und Wales werden etwa 30.000 Patienten pro Jahr mit einer Paracetamolvergiftung als Folge eines Versuchs der Selbstschädigung ins Krankenhaus eingeliefert, von denen etwa 150 der Vergiftung erliegen. Eine Beschränkung der Packungsgröße von Paracetamolpräparaten zeigte nur einen beschränkten Effekt auf die Suizidhäufigkeit.[41] Wie in Großbritannien[42] ist Paracetamol auch in den USA die häufigste Ursache für akutes Leberversagen, wobei etwa die Hälfte der Intoxikationen unbeabsichtigt geschehen.[38] Auch in den urbanen Regionen Deutschlands haben Paracetamolvergiftungen die virale Hepatitis (Virushepatiden) als häufigste Ursache für akutes Leberversagen abgelöst.[43] 2011 ersuchte die US-amerikanische Zulassungsbehörde FDA die Hersteller von solchen Arzneimitteln, in denen Paracetamol mit einem Opioid kombiniert ist, die Paracetamoldosis auf 325 mg pro Dosierungseinheit zu limitieren, um das Risiko für lebertoxische Effekte zu reduzieren. Für OTC-Arzneimittel will die FDA ebenfalls Maßnahmen erarbeiten.[44]
Erste Symptome einer akuten Paracetamolvergiftung, die innerhalb der ersten 48 Stunden eintreten und nach etwa vier bis sechs Tagen ihren Höhepunkt erreichen, sind Übelkeit, Erbrechen, Appetitlosigkeit, Blässe und anhaltende Unterleibsschmerzen als Zeichen einer Leberschädigung. Gleichzeitig können klinische Werte, wie Lebertransaminasen, Laktatdehydrogenase, Bilirubinwert und Prothrombinzeit erhöht sein. Folgt keine umgehende Behandlung, so erleiden etwa 10 % der Patienten mit einer akuten Paracetamolvergiftung eine dauerhafte, schwere Leberschädigung. Etwa 10 bis 20 % dieser Patienten wiederum sterben an den Folgen eines Leberversagens. Seltener tritt akutes Nierenversagen auf.[39] Das Risiko einer Nephropathie durch jahrelangen chronischen Paracetamolkonsum ist ab einer kumulativen Dosis von 1 kg signifikant erhöht.[45] Andere leberunabhängige Symptome, die nach einer Paracetamolvergiftung beobachtet wurden, sind Herzmuskelanomalien und Pankreatitis.[15]
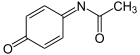
Als Ursache für die Lebertoxizität von Paracetamol gilt sein Stoffwechselprodukt Gegenmittel bei einer Paracetamolvergiftung ist N-Acetylcystein, das toxische Paracetamolmetabolite, wie N-Acetyl-p-benzochinonimin, unter Bildung ungiftiger Konjugate abfängt. Hierdurch kann eine Progression zur irreversiblen Leberschädigung oder zum Leberversagen verhindert werden, vorausgesetzt das Antidot wird rechtzeitig verabreicht.[42] N-Acetylcystein gilt als wirksam, falls es innerhalb von zehn Stunden verabreicht wird. Verschiedene Behandlungsschemata empfehlen die Anwendung von etwa 150 mg/kg Körpergewicht als Einzeldosis und eine Gesamtdosis von 300 bis 1330 mg/kg Körpergewicht verteilt über 20 bis 68 Stunden. Zu diesem Zweck steht N-Acetylcystein zur intravenösen Verabreichung als auch zur oralen Anwendung (Brausetabletten) zur Verfügung. Unmittelbar bis etwa eine Stunde nach Einnahme einer Überdosis Paracetamol kann auch Aktivkohle angewendet werden.[46] Bei einem fortgeschrittenen akuten Leberversagen ist jedoch die Lebertransplantation die einzige verbleibende Therapieoption, welche dem Patienten noch eine Überlebenschance eröffnet.[42]
Anwendung in der Tierheilkunde
Auf Grund der potenziell leberschädigenden Wirkung sollte Paracetamol in der Tierheilkunde mit Vorsicht eingesetzt werden. Bei Katzen und Jungtieren führt die Gabe von Paracetamol sehr schnell zu Vergiftungen mit Methämoglobinbildung, Anämie, Hämoglobinurie, Leberschädigung, Gelbsucht, Atemnot und Herzrasen, da diese den Wirkstoff nur unzureichend glucuronidieren können. Hunde vertragen den Wirkstoff zwar gut,[47] aber die Wirkungsdauer ist sehr kurz (etwa 2 Stunden), so dass der Wirkstoff praktisch ohne sinnvolle Anwendung ist. Unter den Nutztieren ist die Anwendung von Paracetamol bei Schweinen erlaubt, wobei eine Rückstandmengenbegrenzung nicht notwendig ist (Anhang II der Verordnung 2377/90).[48] Auf Schlangen sollen bereits kleinste Mengen von Paracetamol eine tödliche Wirkung entfalten.[49][50]
Pharmakologie
Wirkungsweise (Pharmakodynamik)
Anders als die Schmerzmittel Acetylsalicylsäure oder Ibuprofen besitzt Paracetamol eine lediglich unter Laborbedingungen feststellbare entzündungshemmende Wirkung und wird entsprechend nicht in die Gruppe der klassischen „nicht-steroidalen Entzündungshemmer“ (auch: nicht-steroidale Antirheumatika, NSAR; englisch non-steroidal anti-inflammatory drugs, NSAID) eingeordnet. Im Gegensatz zu den klassischen NSAR hat Paracetamol kaum Wirkung auf die periphere Cyclooxygenase. Aus diesem Grund sind die Nebenwirkungen (u. a. Magen-Darm-Ulzera) deutlich geringer ausgeprägt. Paracetamol hat auch praktisch keinen Einfluss auf die Aggregation der Blutplättchen und somit keine blutgerinnungshemmende Wirkung wie Acetylsalicylsäure.
Der genaue Wirkmechanismus von Paracetamol ist bis heute nicht bekannt. Bekannt ist, dass mehrere, kontrovers diskutierte Mechanismen zusammenspielen, und dass der schmerzstillende Effekt zu einem nicht unerheblichen Teil in Gehirn und Rückenmark zustande kommt.
Hemmung von Cyclooxygenasen
Basierend auf den Entdeckungen John Vanes wurde lange Zeit angenommen, dass der schmerzstillende Effekt des Paracetamols auf die Cyclooxygenasen, die an Entzündungsreaktionen und der Schmerzentstehung beteiligte Enzyme sind, zurückzuführen ist.[51] Die Cyclooxygenase-Enzyme sind über die Bildung von Schmerz- und Entzündungsmediatoren aus der Gruppe der Prostaglandine maßgeblich an der Schmerzweiterleitung ins Gehirn beteiligt.[52] Mit einer Hemmung der Cyclooxygenasen konnte zwar die vergleichbare analgetische Wirkstärke von Paracetamol und saurer Nicht-Opioidanalgetika, wie beispielsweise Acetylsalicylsäure und Ibuprofen, erklärt werden, aber nicht die weitgehend fehlende antiinflammatorische Wirksamkeit und die ebenso weitgehend fehlenden gastro-intestinalen Nebenwirkungen des Paracetamols. Als Ursache für diese Unterschiede wurde eine voneinander abweichende Verteilung von Paracetamol und saurer Nicht-Opioidanalgetika in Körpergewebe angenommen, wobei Paracetamol sich gleichmäßig im Körper verteilt und saure Nicht-Opioidanalgetika sich im Sinne eines Drug Targetings beispielsweise im Magen und im entzündeten Gewebe anreichern.[53] Eine weitere mögliche Erklärung wurde mit der Entdeckung des Cyclooxygenase-Isoenzyms COX-3, einer insbesondere in der Großhirnrinde vorkommenden Variante der COX-1, gefunden.[54] Neueren Untersuchungen zufolge soll eine schwach dämpfende Wirkung auf das Cyclooxygenase-Isoenzyms COX-1 und eine starke auf COX-2 in vivo für die Wirkungen von Paracetamol verantwortlich sein.[3] Dies passt zu seiner schwachen Wirkung auf Thrombozyten (Blutplättchen).[55]
Wechselwirkungen mit dem Serotoninsystem
Weitere experimentelle Daten lassen vermuten, dass Paracetamol seine Effekte über eine Aktivierung serotoninerger schmerzhemmender Mechanismen vermittelt. Insbesondere Serotonin-Rezeptoren vom Typ 5-HT3 sollen dabei eine wichtige Rolle spielen.[56] Der schmerzhemmende Effekt wird dabei auf eine Projektion serotoninerger Neurone bis in das Rückenmark zurückgeführt. Diese Hypothese über den Mechanismus des Paracetamols zeigt Analogien zur Wirkweise von Opioiden, wie Morphin.[57] Alternativ dazu kann ein schmerzstillender serotoninerger Effekt des Paracetamols auch als eine Folge der Hemmung der Prostaglandinfunktion interpretiert werden, da die meisten serotoninergen Neurone auch Prostanoidrezeptoren exprimieren.[58]
Wechselwirkungen mit dem Endocannabinoidsystem
Eine Wechselwirkung von Paracetamol mit dem körpereigenen Cannabinoidsystem (Endocannabinoid-System) wurde auf Grund einer zusätzlich zur analgetischen Wirkung existierenden schwachen euphorisierenden, entspannenden und beruhigenden Wirkung von Analgetika vom Anilin-Typ vermutet.[57] In der Tat konnte eine Wechselwirkung von Paracetamol mit dem Endocannabinoidsystem in vivo nachgewiesen werden. So zeigt ein Metabolit des Paracetamols, das Vanilloid-Rezeptor TRPV1, der auf vielen, als Nozizeptoren fungierenden freien Nervenendigungen vorkommt und zusätzlich an der Regulation der Körpertemperatur beteiligt ist. Darüber hinaus hemmt dieser Paracetamolmetabolit die zelluläre Wiederaufnahme des Anandamid und führt somit zu einer Konzentrationserhöhung dieses endogenen Cannabinoids.[59][60]
Sonstige Wirkmechanismen
Neben einer Interaktion von Paracetamol mit Cyclooxygenasen, dem Serotonin-System und dem Endocannabinoidsystem wird ein hemmender Einfluss des Paracetamols auf eine durch Glutamat oder Substanz P verursachte Hyperalgesie als Ursache für seine analgetische Wirkung diskutiert. Zusätzlich ist Paracetamol an der Hemmung der Freisetzung des Botenstoffs Stickstoffmonoxid (NO) beteiligt.[59]
Darüber hinaus gibt es Hinweise, dass Paracetamol nicht nur physischen Schmerz, sondern auch durch soziale Ausgrenzung oder eine Zurückweisung hervorgerufenes psychisches Leiden (sog. sozialer Schmerz, social pain), zu lindern vermag.[61][62] Dies ist nach Ansicht der Autoren ein Hinweis darauf, dass es hinsichtlich der betroffenen Hirnregionen eine substantielle Überlappung zwischen physischen und psychischem Schmerz gibt.
Pharmakokinetik
Die maximale Wirkkonzentration von Paracetamol wird nach etwa 30 bis 60 Minuten nach oraler Gabe erreicht. Bei rektaler Anwendung, bei der eine Bioverfügbarkeit von 68 bis 88 % erreicht wird, werden maximale Plasmakonzentrationen nach circa 3 bis 4 Stunden erreicht.[15] Die Plasmahalbwertszeit liegt bei 1 bis 4 Stunden.[63] Bei Frühgeborenen kann sie auf Grund eines noch nicht voll entwickelten Stoffwechselsystems deutlich darüber liegen.[64]
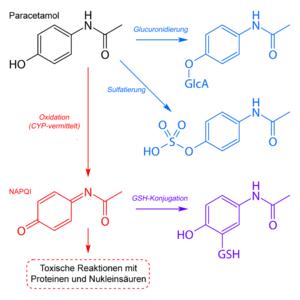
Der Abbau von Paracetamol erfolgt vor allem in der Leber, wo der größte Teil des Stoffes im Rahmen einer Phase-II-Reaktion durch Verbindung mit Sulfat oder Glucuronsäure inaktiviert (Glucuronidierung) und dann über die Nieren ausgeschieden wird.
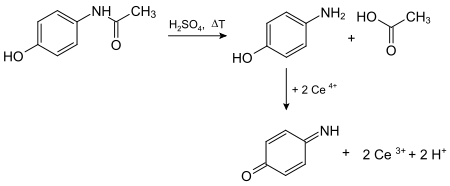
Die toxische Wirkung lässt sich auf ein in kleinen Mengen entstehendes Produkt zurückführen, das insbesondere über den Abbau über das Cytochrom-P450-Enzymsystem entsteht, das N-Acetyl-p-benzochinonimin. An der Bildung dieses sehr reaktionsfähigen Metabolits ist insbesondere das Cytochrom-P450-Isoenzym CYP 2E1, ferner aber auch CYP 1A2 und CYP 3A4 beteiligt. Normalerweise wird N-Acetyl-p-benzochinonimin sofort über die Reaktion mit dem Glutathion (GSH) abgefangen und das entstandene Produkt über die Niere ausgeschieden. Glutathion steht jedoch nur in begrenztem Umfang in der Leber zur Verfügung und seine Nachbildung kann nicht genügend gesteigert werden. Daher erschöpft sich bei der akuten Überdosierung mit Paracetamol der Glutathion-Anteil. Das N-Acetyl-p-benzochinonimin reagiert nun mit Struktur- und Funktionsproteinen der Leberzellen, was zur Leberzellnekrose und klinischem Leberversagen führen kann. Ein chronischer Alkoholkonsum und enzyminduzierende Arzneistoffe verstärken die Verstoffwechselung von Paracetamol über das Cytochrom-P450-Enzymsystem zu N-Acetyl-p-benzochinonimin und verstärken somit die Toxizität von Paracetamol.[39]
Ein alternativer Abbauweg des Paracetamols unter Beteiligung Cytochrom-P450-Isoenzyme CYP2A6 und CYP2B1 führt zu 3-Hydroxyparacetamol. Dieser Metabolit, der nach Glucuronidierung ausgeschieden wird, zeigt eine deutlich niedrigere Toxizität als N-Acetyl-p-benzochinonimin.
Chemie
Struktur
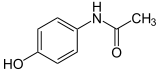
Paracetamol ist ein Derivat des para-Aminophenols, also zugleich ein Phenol (N-Acetyl-p-aminophenol) und ein Derivat des Anilins (p-Hydroxyacetanilid). Daneben lässt sich Paracetamol auch als Acetamid, also als Amid der Essigsäure auffassen, woraus sich der nach IUPAC-Regularien vergebene Name N-(4-Hydroxyphenyl)acetamid ergibt.
Auf Grund der enthaltenen Anilinstruktur wird Paracetamol wie auch Acetanilid, Phenacetin und Propacetamol der Schmerzmittelgruppe der Anilinderivate zugerechnet. Acetanilid, Phenacetin und Propacetamol können dabei als Vorstufen (Prodrugs) angesehen werden, die im Organismus zu Paracetamol umgewandelt werden.
Stoffeigenschaften
Paracetamol ist ein weißer, kristalliner Feststoff, der in mindestens zwei verschiedenen Modifikationen vorkommt. Diese Polymorphie ist von pharmazeutischer Bedeutung und hat Auswirkungen auf die Verpressbarkeit des Arzneistoffs. Orthorhombisches Paracetamol zeigt dabei eine der thermodynamisch stabileren monoklinen[65] Modifikation überlegene Verpressbarkeit.[66] Paracetamol ist in beiden Modifikationen in Alkoholen gut löslich, in kaltem Wasser dagegen nur mäßig (14 g/L bei 20 °C), wohl aber in kochendem Wasser. Paracetamol hat eine Dichte von 1,293 Gramm pro Kubikzentimeter.[1] Es ist als Phenol schwach sauer. Der pH-Wert einer gesättigten, wässrigen Lösung liegt bei etwa sechs. Paracetamol hat einen charakteristischen, leicht bitteren Geschmack.
Herstellung
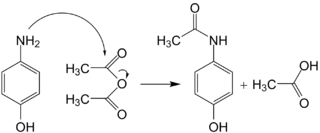
Für die Herstellung von Paracetamol wurden verschiedene Synthesewege beschrieben. Das klassische Verfahren bedient sich der N-Acetylierung von p-Aminophenol.[67] Dieser Grundstoff ist herstellbar durch Nitrierung und nachfolgender Reduktion von Phenol oder alternativ ausgehend von Anilin oder p-Chlorphenol. Zur Acetylierung des Aminophenols lässt man es mit überschüssigem Essigsäureanhydrid reagieren, wobei unter Abspaltung von Essigsäure das Endprodukt wie auch N,O-diacetyliertes Nebenprodukt entsteht. Letzteres hydrolysiert im wässrigen Medium oder im schwach alkalisierten Milieu aufgrund der höheren Hydrolyseempfindlichkeit der Ester- gegenüber der Amidbindung selektiv zu Paracetamol.
Ein Verfahren der industriellen Großproduktion geht von Phenol aus und umfasst drei Schritte. Phenol wird mit Acetanhydrid in Gegenwart von Flusssäure in para-Stellung zu p-Hydroxyacetophenon acetyliert. Alternativ lässt sich p-Hydroxyacetophenon auch aus Phenylacetat bei niedriger Temperatur und mit Aluminiumchlorid als Lewis-Säure gewinnen (Fries-Umlagerung). Das p-Hydoxyacetophenon kondensiert man anschließend mit Hydroxylamin zum Oxim. Dieses lagert sich in Gegenwart von Thionylchlorid gemäß Beckmann zu Paracetamol um.[67]
Eine jüngere Variante ist die reduzierende Amidierung von p-Nitrophenol mit Thioessigsäure.[68]
Analytik
Nach dem Europäischen Arzneibuch kann Paracetamol mit Hilfe chemischer und instrumenteller analytischer Verfahren identifiziert werden. So kann Paracetamol durch Oxidation mit Kaliumdichromat unter Bildung eines blauen Farbstoffs nachgewiesen werden. Die Acetylgruppe lässt sich nach Hydrolyse mit Hilfe von Lanthannitrat und Iod nachweisen.[69] Alternativ dazu lässt sich Paracetamol nach Hydrolyse mit Hilfe von Formaldehyd durch eine positive Marquis-Reaktion nachweisen. Das Hydrolyseprodukt gibt auch einen positiven Nachweis auf primäre aromatische Amine. Die Phenolstruktur kann auch mit Eisen(III)-chlorid identifiziert werden, wobei sich ein blauer, säurelabiler Komplex bildet.
Die Gehaltsbestimmung von Paracetamol erfolgt nach dem Europäischen Arzneibuch nach hydrolytischer Spaltung des Paracetamols zu p-Aminophenol klassisch als oxidimetrische Titration mit Hilfe der Cerimetrie.[69] Alternative Gehaltsbestimmungsmethoden schließen instrumentelle Verfahren, wie HPLC ein. Für die quantitative Bestimmung von Paracetamol im Blutplasma oder im Serum stehen neben HPLC- und Gaschromatographie-Verfahren auch colorimetrische Assays und Immunassays zur Verfügung.
Handelspräparate
Wirtschaftsdaten, Abgaberegelung
Paracetamol zählt weltweit zu den meistverkauften Arzneimitteln. Das Monopräparat Paracetamol-ratiopharm war mit über 20 Millionen Packungseinheiten im Jahr 2008 das in Deutschland am zweithäufigsten gekaufte Arzneimittel. Auch das Kombinationspräparat Thomapyrin (12,4 Millionen Packungseinheiten im Jahr 2008) findet sich in der Top 10 der meistgekauften Arzneimittel wieder.[70] Der jährliche Gesamtumsatz von Paracetamol in Deutschland wird auf etwa 80 Millionen Packungen mit einem Marktwert von etwa 145 Millionen Euro geschätzt.[71]
Die meisten Paracetamol-Präparate unterliegen nicht der Verschreibungspflicht. Kombinationspräparate mit Codein, Metoclopramid und Tramadol sowie paracetamolhaltige Infusionslösungen unterliegen in Deutschland der Verschreibungspflicht. Seit April 2009 wurden in Deutschland zusätzlich alle Paracetamolpräparate mit einer Wirkstoffmenge von über 10 g pro Packungseinheit (ausgenommen Zäpfchen) der Verschreibungspflicht unterstellt. Mit dieser Maßnahme soll versucht werden, die Häufigkeit durch missbräuchliche Anwendung entstandener Paracetamolvergiftungen zu reduzieren.[72] Ähnliche Beschränkungen in Großbritannien führten zu einem geringfügigen Rückgang paracetamolbedingter Todesfälle.[41]
Monopräparate
Acetalgin (CH), ben-u-ron (D, CH), Captin (D), Contac (D), Contra-Schmerz (CH), Dafalgan (CH), Dolprone (CH), Enelfa Dr. Henk (D), GRIPPEX (D), Mexalen (A), Mexa-Vit C (A), Panadol (CH), Parapaed (D), Perfalgan (A, D), RubieMol (A), Tylenol (USA, CH) sowie zahlreiche Generika.
Kombinationspräparate
- mit Acetylsalicylsäure: Fibrex (D), Thomapyrin 300 mg/200 mg (D)
- mit Butylscopolamin: Buscopan (D)
- mit Coffein: Azur (D), COPYRKAL (D), Neopyrin (D), Octadon (D), Prontopyrin (D), Vivimed (D)
- mit Codein: Contraneural (D), Gelonida (D), Nedolon (D), Optipyrin (D), Paracetamol comp. STADA (D), talvosilen (D), Titretta (D)
- mit Diphenhydramin: Panadol PM (USA)
- mit Metoclopramid: Migraeflux MCP (D), Migräne-Neuridal (D), Migränerton (D), Migralave + MCP (D)
- mit Phenylephrin: Doregrippin (D)
- mit Tramadol: DOLEVAR (D), Zaldiar (D)
Mehrfachkombinationen:
- mit Acetylsalicylsäure und Coffein: Chephapyrin (D), dolomo (D), Dolopyrin (D), HA-Tabletten N (D), Melabon (D), Neuralgin (D), Novo Petrin (D), ratiopyrin (D), Thomapyrin CLASSIC (D), Thomapyrin INTENSIV (D), TITRALGAN (D), Thomapyrin (A), InfluASS (A), Irocophan (A)
- mit Ascorbinsäure, Coffein und Chlorphenamin: Grippostad (D)
- mit Coffein und Codein: Azur compositum (D)
- mit Acetylsalicylsäure und Ascorbinsäure: Grippal + C (D)
- mit Guaifenesin, Phenylephrin und Ascorbinsäure: WICK DayMed Erkältungs-Getränk für den Tag (D)
- mit Phenylpropanolamin und Dextromethorphan: Basoplex Erkältungs-Kapseln (D), WICK DayMed Erkältungs-Kapseln (D)
- mit Doxylamin, Ephedrin, Dextromethorphan: WICK MediNait Erkältungssirup (D)
- mit Doxylamin und Dextromethorphan: WICK MediNait Erkältungssirup mit Honig- und Kamillenaroma (D, CH)
- mit Phenylephrin und Dextromethorphan: Contac Erkältungs-Trunk Forte (D)
- mit Propyphenazon und Coffein: Saridon (D)
- mit Pheniramin, Phenylephrin, Ascorbinsäure: Neo Citran (A, CH)
Literatur
- Bertolini A, Ferrari A, Ottani A, Guerzoni S, Tacchi R, Leone S: Paracetamol: new vistas of an old drug. In: CNS Drug Reviews. 12, Nr. 3–4, 2006, S. 250–275. doi:10.1111/j.1527-3458.2006.00250.x. PMID 17227290. Abgerufen am 3. August 2009.
- Ernst Mutschler et al.: Mutschler – Arzneimittelwirkungen Lehrbuch der Pharmakologie und Toxikologie. 9. Auflage. Wissenschaftl. Verlagsgesellschaft, Stuttgart 2008, ISBN 978-3-8047-1952-1.
Weblinks
 Commons: Paracetamol – Sammlung von Bildern, Videos und Audiodateien
Commons: Paracetamol – Sammlung von Bildern, Videos und Audiodateien- Superbrands: Panadol (englisch)
Einzelnachweise
- ↑ a b c d e f g Eintrag zu CAS-Nr. 103-90-2 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 27. November 2007 (JavaScript erforderlich).
- ↑ a b Cornelia Imming: Acetylaminophenole, in: Roempp Online - Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
- ↑ a b B. Hinz, O. Cheremina, K. Brune: Acetaminophen (paracetamol) is a selective cyclooxygenase-2 inhibitor in man, in: FASEB J. 2008 Feb;22(2) S. 383–390; PMID 17884974.
- ↑ Picciochi, R.; Diogo, H.P.; Minas da Piedade, M.E.: Thermochemistry of paracetamol in J. Therm. Anal. Calorim. 100 (2010) 391–401. doi:10.1007/s10973-009-0634-y
- ↑ Di Martino, P.; Conflant, P.; Drache, M.; Huvenne, J.P.; Guyot-Hermann, A.M.: Preparation and physical characterization of forms II and III of paracetamol in J. Therm. Anal. 48 (1997) 447 - 458
- ↑ a b c Paracetamol bei ChemIDplus.
- ↑ a b Datenblatt Acetaminophen bei Sigma-Aldrich, abgerufen am 2. April 2011.
- ↑ H. N. Morse: Ueber eine neue Darstellungsmethode der Acetylamidophenole. In: Berichte der deutschen chemischen Gesellschaft. 11, Nr. 1, 1878, S. 232–233. doi:10.1002/cber.18780110151.
- ↑ Von Mering J. (1893). Beiträge zur Kenntnis der Antipyretica. Ther. Monatsch. 7: S. 577–587.
- ↑ "A Festival of Analgesics." Chemical Heritage Foundation. 2001.
- ↑ bene-Arzneimittel: Meilensteine: Der Weg in die Zukunft.
- ↑ U. S. Mantzke, A. M. Brambink: Paracetamol im Kindesalter. Der Anaesthesist, Ausgabe 9-2002
- ↑ G. Dunea: Death over the counter, in: Br Med J, 1983, 286, S. 211–212; PMID 6401533; PMC 1546319.
- ↑ K. A. Wolnik, F. L. Fricke, E. Bonnin, C. M. Gaston, R. D. Satzger: The Tylenol tampering incident – tracing the source, in: Anal. Chem., 1984, 56, S. 466A–470A, 474A; PMID 6711821.
- ↑ a b c d e f g h i j k Fachinformation (Mustertext des BfArM für Paracetamol), Stand: 10. Juni 2008.
- ↑ Fachinformation: Fixe Arzneistoffkombination Paracetamol 400 mg/Coffein 50 mg Tabletten Bundesinstitut für Arzneimittel und Medizinprodukte. Stand 23. Januar 2008.
- ↑ Diener HC, Pfaffenrath V, Pageler L, Peil H, Aicher B: The fixed combination of acetylsalicylic acid, paracetamol and caffeine is more effective than single substances and dual combination for the treatment of headache: a multicentre, randomized, double-blind, single-dose, placebo-controlled parallel group study. In: Cephalalgia. 25, Nr. 10, Oktober 2005, S. 776–787. doi:10.1111/j.1468-2982.2005.00948.x. PMID 16162254.
- ↑ Evers S, May A, Fritsche G, Kropp P, Lampl C, Limmroth V, Malzacher V, Sandor S, Straube A, Diener HC: Akuttherapie und Prophylaxe der Migräne - Leitlinie der Deutschen Migräne- und Kopfschmerzgesellschaft und der Deutschen Gesellschaft für Neurologie. In: Nervenheilkunde. 27, Nr. 10, 2008, S. 933–949.
- ↑ Deutsche Migräne- und Kopfschmerz-Gesellschaft: Spannungskopfschmerz selbst behandeln - Selbstmedikation für Patienten
- ↑ Fachinformation: Fixe Arzneistoffkombination Paracetamol 500 mg/Codeinphosphat-Hemihydrat 30 mg Bundesinstitut für Arzneimittel und Medizinprodukte. Stand 5. September 2008.
- ↑ Persky V, Piorkowski J, Hernandez E, et al.: Prenatal exposure to acetaminophen and respiratory symptoms in the first year of life. In: Ann. Allergy Asthma Immunol.. 101, Nr. 3, September 2008, S. 271–278. doi:10.1016/S1081-1206(10)60492-9. PMID 18814450. Volltext bei PMC: 2578844.
- ↑ Allmers H, Skudlik C, John SM: Acetaminophen use: a risk for asthma?. In: Curr Allergy Asthma Rep. 9, Nr. 2, März 2009, S. 164–167. PMID 19210907.
- ↑ Farquhar H, Stewart A, Mitchell E, et al.: The role of paracetamol in the pathogenesis of asthma. In: Clin. Exp. Allergy. 40, Nr. 1, Januar 2010, S. 32–41. doi:10.1111/j.1365-2222.2009.03378.x. PMID 20205695.
- ↑ Bancos S, Bernard MP, Topham DJ, Phipps RP: Ibuprofen and other widely used non-steroidal anti-inflammatory drugs inhibit antibody production in human cells. In: Cell Immunol. 258, Nr. 1, 2009, S. 18-28. PMID 19345936.
- ↑ Blaho, V. A. et al.: Cyclooxygenase-1 orchestrates germinal center formation and antibody class-switch via regulation of IL-17. In: J Immunol. 183, Nr. 9, 2009, S. 5644–5653. PMID 19843949.
- ↑ Prymula, R. et al.: Effect of prophylactic paracetamol administration at time of vaccination on febrile reactions and antibody responses in children: two open-label, randomised controlled trials. In: Lancet. 374, Nr. 9698, 2009, S. 1339–1350. PMID 19837254. (PDF)
- ↑ Common Pain Relievers May Dilute Power of Flu Shots. University of Rochester Medical Center (URMC). Abgerufen am 27. Juli 2011.
- ↑ Schmerzmittel schwächen Impfschutz. Spiegel Online. Abgerufen am 4. Dezember 2009.
- ↑ Bernard MP, Phipp RP: Inhibition of cyclooxygenase-2 impairs the expression of essential plasma cell transcription factors and human B-lymphocyte differentiation. In: Immunology. 129, Nr. 1, 2010, S. 87-96. PMID 20050331.
- ↑ Over-the-Counter Pain Drugs May Affect Vaccine Strength. WXXI. Abgerufen am 27. Juli 2011.
- ↑ Impfeffekt kann durch manche Medikamente deutlich abgeschwächt werden. Lungenärzte im Netz. Abgerufen am 4. Dezember 2009.
- ↑ Effect of Prophylactic Paracetamol Administration at Time of Vaccination on Febrile Reactions and Antibody Responses in Children F1000 Ranking: "Exceptional" and Changes Clinical Practice". Medscape. Abgerufen am 26. Juli 2011.
- ↑ Feinstein AR, Heinemann LA, Curhan GC, et al.: Relationship between nonphenacetin combined analgesics and nephropathy: a review. Ad Hoc Committee of the International Study Group on Analgesics and Nephropathy. In: Kidney Int.. 58, Nr. 6, Dezember 2000, S. 2259–2264. doi:10.1046/j.1523-1755.2000.00410.x. PMID 11115060.
- ↑ R. Beasley: "Association between paracetamol use in infancy and childhood, and risk of asthma, rhinoconjunctivitis, and eczema in children aged 6–7 years: analysis from Phase Three of the ISAAC programme", in: The Lancet 2008 Sep 20, 372 (9643), S. 1039–1048; PMID 18805332.
- ↑ Beasley R. W. et al.: Acetaminophen Use and Risk of Asthma, Rhinoconjunctivitis and Eczema in Adolescents: ISAAC Phase Three. In: Am. J. Respir. Crit. Care Med.. 2010. doi:10.1164/rccm.201005-0757OC. PMID 20709817.
- ↑ Lowe AJ et al. BMJ 2010 341, 4616
- ↑ G. Pickering, E. Schneider u.a.: Acetaminophen metabolism after major surgery: a greater challenge with increasing age. In: Clinical pharmacology and therapeutics. Band 90, Nummer 5, November 2011, S. 707–711, ISSN 1532-6535. doi:10.1038/clpt.2011.176. PMID 21975347.
- ↑ a b Larson A. M. et al.: Acetaminophen-induced acute liver failure: results of a United States multicenter, prospective study. In: Hepatology. 42, Nr. 6, 2005, S. 1364–1372. PMID 16317692.
- ↑ a b c Roberts, L. Jackson; Morrow, Jason D.: Analgesic-antipyretic and antiinflammatory agents and drugs employed in the treatment of gout. In: Gilman, Alfred; Goodman, Louis Sanford; Hardman, Joel G.; Limbird, Lee E. (Hrsg.): Goodman & Gilman's the pharmacological basis of therapeutics, S. 687–732, New York: McGraw-Hill 2001, ISBN 0-07-112432-2
- ↑ Williams, Roger Lawrence; Jean-Pierre Benhamou; Lee, William Thomas: Acute liver failure. Cambridge, UK: Cambridge University Press 1997, ISBN 0-521-55381-4
- ↑ a b Morgan OW, Griffiths C, Majeed A: Interrupted time-series analysis of regulations to reduce paracetamol (acetaminophen) poisoning. In: PLoS Med.. 4, Nr. 4, April 2007, S. e105. doi:10.1371/journal.pmed.0040105. PMID 17407385. Volltext bei PMC: 1845154.
- ↑ a b c Chun, L. J. et al.: Acetaminophen hepatotoxicity and acute liver failure.. In: J Clin Gastroenterol.. 43, Nr. 4, 2009, S. 342–349. PMID 19169150.
- ↑ Canbay, A. et al.: Acute liver failure in a metropolitan area in Germany: a retrospective study (2002 - 2008). In: Z Gastroenterol.. 47, Nr. 9, 2009, S. 807–813. PMID 19750427.
- ↑ Pressemitteilung der FDA verfügbar als html, zuletzt abgerufen am 14. Januar 2011
- ↑ Granese J, Brightbill K, Osborne P, Cox CE, Gaber LW: Analgesic nephropathy selectively affecting a unilateral non-functioning hypoplastic kidney. In: Clin. Nephrol.. 68, Nr. 2, August 2007, S. 115–120. PMID 17722712.
- ↑ H. Kupferschmidt:Therapie der Paracetamolvergiftung Schweizerisches Toxikologisches Informationszentrum
- ↑ Julia Nakagawa et al.: Nebenwirkungen durch nicht zugelassene nichtsteroidale Entzündungshemmer (NSAID) bei 21 Hunden. In: Kleintierpraxis 55 (2010), S. 364–370.
- ↑ Wolfgang Löscher und Fritz Rupert Ungemach: Pharmakotherapie bei Haus- und Nutztieren. Paul Parey, 7. Aufl. 2006, S. 106–107, ISBN 978-3-8304-4160-1.
- ↑ US Army setzt mit Paracetamol vergiftete Schlangenköder ein.
- ↑ Stars and Stripes: Mice join fight against invasive snakes on Guam
- ↑ Flower RJ, Vane JR: Inhibition of prostaglandin synthetase in brain explains the anti-pyretic activity of paracetamol (4-acetamidophenol). In: Nature. 240, Nr. 5381, Dezember 1972, S. 410–1. PMID 4564318.
- ↑ Olivier Boutaud, David M. Aronoff, Jacob H. Richardson, Lawrence J. Marnett, and John A. Oates: Determinants of the cellular specificity of acetaminophen as an inhibitor of prostaglandin H2 synthases, in: Proc. Natl. Acad. Sci. U.S.A, 2002, 99, S. 7130–7135; PMID 12011469; PMC 124540.
- ↑ Brune K, Rainsford KD, Schweitzer A: Biodistribution of mild analgesics. In: Br J Clin Pharmacol. 10 Suppl 2, Oktober 1980, S. 279S–284S. PMID 6969084. Volltext bei PMC: 1430188.
- ↑ Chandrasekharan NV, Dai H, Roos KL, et al.: COX-3, a cyclooxygenase-1 variant inhibited by acetaminophen and other analgesic/antipyretic drugs: cloning, structure, and expression. In: Proc. Natl. Acad. Sci. U.S.A.. 99, Nr. 21, Oktober 2002, S. 13926–13931. doi:10.1073/pnas.162468699. PMID 12242329. Volltext bei PMC: 129799.
- ↑ C. Frölich: Selektive Cyclooxygenasehemmer: Eine neue Generation von Antirheumatika, in: Deutsches Ärzteblatt, 1996, 93 (47), A-3100 / B-2632 / C-2438 Medizinreport.
- ↑ Pickering G, Estève V, Loriot MA, Eschalier A, Dubray C: Acetaminophen reinforces descending inhibitory pain pathways. In: Clin. Pharmacol. Ther.. 84, Nr. 1, Juli 2008, S. 47–51. doi:10.1038/sj.clpt.6100403. PMID 17957182.
- ↑ a b Anderson BJ: Paracetamol (Acetaminophen): mechanisms of action. In: Paediatr Anaesth. 18, Nr. 10, Oktober 2008, S. 915–921. doi:10.1111/j.1460-9592.2008.02764.x. PMID 18811827.
- ↑ Graham GG, Scott KF: Mechanism of action of paracetamol. In: Am J Ther. 12, Nr. 1, 2005, S. 46–55. PMID 15662292.
- ↑ a b Alfio Bertolini, Anna Ferrari, Alessandra Ottani, Simona Guerzoni, Raffaella Tacchi, Sheila Leone: Paracetamol: New vistas of an old drug], in: CNS Drug Reviews, 2006, 12, S. 250–275; PMID 17227290; doi:10.1111/j.1527-3458.2006.00250.x.
- ↑ E. D. Högestätt, B. A. Jönsson, A. Ermund, D. A. Andersson, H. Björk, J. P. Alexander, B. F. Cravatt, A. I. Basbaum, P. M. Zygmunt: Conversion of acetaminophen to the bioactive N-acylphenolamine AM404 via fatty acid amide hydrolase-dependent arachidonic acid conjugation in the nervous system, in: J. Biol. Chem., 2005, 280 (36), S. 31405–31412; PMID 15987694.
- ↑ Dewall CN, Macdonald G, Webster GD, Masten CL, Baumeister RF, Powell C, Combs D, Schurtz DR, Stillman TF, Tice DM, Eisenberger NI: Acetaminophen reduces social pain: behavioral and neural evidence. In: Psychol Sci. 21, Nr. 7, 2010, S. 931-937. PMID 20548058.
- ↑ Dewall CN: Hurt feelings? You could take a pain reliever.... In: Harv Bus Rev. 89, Nr. 4, 2011, S. 28-29. PMID 21510517.
- ↑ Rote Liste 2009. Rote Liste Service. ISBN 3-939192-30-9.
- ↑ van Lingen RA, Deinum JT, Quak JM, et al.: Pharmacokinetics and metabolism of rectally administered paracetamol in preterm neonates. In: Arch. Dis. Child. Fetal Neonatal Ed.. 80, Nr. 1, Januar 1999, S. F59–63. PMID 10325815. Volltext bei PMC: 1720876.
- ↑ Acta Cryst. (2009). B65, 363–374
- ↑ Scientific considerations of pharmaceutical solid polymorphism in regulatory applications. In: Rolf Hilfiker (Hrsg.): Polymorphism: in the Pharmaceutical Industry, S. 385–404, Chichester: John Wiley & Sons 2006, ISBN 3-527-31146-7
- ↑ a b Thomas Christoph; Helmut Buschmann: Cyclogenase inhibition: From NSAIDs to selective COX-2 inhibitors. In: Bernd Sundermann; Helmut Buschmann; Thomas Christoph; Elmar Friderichs; Corinna Maul (Hrsg.): Analgesics: From Chemistry and Pharmacology to Clinical Application, S. 13–126, Weinheim: Wiley-VCH 2002, ISBN 3-527-30403-7
- ↑ Bhattacharya A. et al: Eco-friendly reductive acetamidation of arylnitro compounds by thioacetate anion through in situ catalytic regeneration: application in the synthesis of Acetaminophen. In: Tetrahedron Letters. 47, Nr. 19, 2006, S. 3221–3223. doi:10.1016/j.tetlet.2006.03.057.
- ↑ a b Europäisches Arzneibuch. 6. Ausgabe. Grundwerk 2008. Monographie Paracetamol. Deutscher Apotheker Verlag Stuttgart. ISBN 978-3-7692-3962-1.
- ↑ Glaeske G., Schicktanz C., Janhsen K. (2009). GEK-Arzneimittelreport 2009. Asgard Verlag. Deutschland. ISBN 978-3-537-44068-6.
- ↑ Klemp C., Heil K. (2008). Paracetamol auf Rezept In: Ruhr Nachreichten vom 26. März 2008.
- ↑ ABDA-Pressemitteilung vom 10. März 2009 - Schmerzmittel mit Paracetamol ab April teilweise rezeptpflichtig

Bitte den Hinweis zu Gesundheitsthemen beachten! 
Dieser Artikel wurde am 23. August 2009 in dieser Version in die Liste der exzellenten Artikel aufgenommen. Kategorien:- ATC-N02
- Gesundheitsschädlicher Stoff
- Wikipedia:Exzellent
- Arzneistoff
- Nichtopioid-Analgetikum
- Phenol
- Anilid
Wikimedia Foundation.