- Glutamatdehydrogenase
-
Glutamatdehydrogenase (NADP+) 1 —
Vorhandene Strukturdaten: 1l1f, 1nr1 Masse/Länge Primärstruktur 505 Aminosäuren Sekundär- bis Quartärstruktur Homohexamer Bezeichner Gen-Name(n) GLUD1, GLUD2 Externe IDs OMIM: 138130 UniProt: P04035 Enzymklassifikation EC, Kategorie 1.4.1.3 Oxidoreduktase Substrat L-Glutamat + H2O + NAD+ Produkte 2-Oxoglutarat + NH3 + NADH/H+ Glutamatdehydrogenase (GDH, auch GLDH) heißt das Enzym, das die Reaktion von L-Glutamat, Wasser und NAD(P)+ zu Ammonium, α-Ketoglutarat und NAD(P)H bzw. deren Rückreaktion katalysiert. Damit ist es ein Teil des Stickstoffmetabolismus und für die Fixierung (Assimilation) bzw. Freisetzung (Dissimilation) von Ammonium von zentraler Bedeutung. GDH kommt in vielen Organismen vor. Beim Menschen existieren zwei Gene (GLUD1 und GLUD2), die für zwei Isoformen der GDH codieren, wobei GLUD2 besonders in der Netzhaut, den Hoden und auch im Gehirn exprimiert wird. Mutationen an GLUD1 können zum Hyperinsulinismus-Hyperammonämie-Syndrom führen.[1]
Während die GDHs höherer Eukaryoten beide Co-Faktoren (NADH und NADPH) nutzen können, sind die GDHs von Prokaryoten und niederer Eukaryoten von einem bestimmten Coenzym abhängig (NADH oder NADPH, EC 1.4.1.2 und EC 1.4.1.4). Hierbei sind NADPH-abhängigen GDHs üblicherweise anabole Enzyme und katalysieren die Assimilation von Ammonium, während NADH-abhängig GDHs zum Katabolismus beitragen und Ammonium meist dissimilieren.
Inhaltsverzeichnis
Vorkommen
Die GDH kommt ausschließlich in Mitochondrien vor, was bei der Diagnostik von Leberschäden eine Rolle spielt. Sie gelangt nämlich anders als Aspartat-Aminotransferase (ASAT) oder Alanin-Aminotransferase (ALAT) erst ins Blut, wenn Leberzellen vollständig zerstört sind.
Katalysierte Reaktion
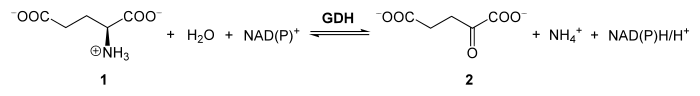
Die katalysierte Reaktion der GDH bei L-Glutamat (1) ist im Schema unten dargestellt. Dieses wird durch das Enzym zu α-Ketoglutarat (2) desaminiert und oxidiert. Das freigewordene Ammonium (NH4+) kann dabei zur weiteren Dissimilation in den Harnstoffzyklus gelangen.
Aufbau
Bei allen bisher untersuchten GDHs handelt es sich um homomere Enyzmkomplexe, welche aus entweder sechs oder vier identischen Untereinheiten aufgebaut sind. Diese Untereinheiten sind entweder 50 kDa, 115 kDa oder 180 kDa groß. GDHs werden entsprechend der Anzahl und Größe der Untereinheiten und auf Grund von Sequenzvergleichen in vier Klassen eingeteilt: α6-50I und α6-50II (kleine GDHs) sowie α4-115 und α6-180 (große GDHs). Den GDHs aller vier Klassen liegt der gleiche katalytische Mechanismus zu Grunde, sie besitzen eine sehr ähnliche Domänenstruktur und zahlreiche stark konservierte Aminosäurereste. Über die Funktion der zusätzlichen Aminosäuren der großen GDHs (α4-115 und α6-180) ist bisher nichts bekannt.
Die GDH aus Clostridium symbiosum ist eine der bisher am besten untersuchten GDHs. Sie ist NADH-abhängig und gehört zur α6-50I-Klasse. Jede der sechs identischen Untereinheiten dieses Enzymkomplexes besteht aus zwei Domänen, welche durch eine Spalte, dem aktiven Zentrum, getrennt sind. Eine der beiden Domänen besitzt die Bindstelle des NADH, während die andere Domäne L-Glutamat bzw. α-Ketoglutarat bindet. Während des katalytischen Zyklus schließt sich der Spalt und die Substrate werden dadurch in eine für der Reaktion günstigen Position gebracht.
Siehe auch
Einzelnachweise
Weblinks
-
 Wikibooks: Biochemie und Pathobiochemie: Glutamat-Dehydrogenase – Lern- und Lehrmaterialien
Wikibooks: Biochemie und Pathobiochemie: Glutamat-Dehydrogenase – Lern- und Lehrmaterialien
Kategorien:- Oxidoreduktase
- Krankheitsassoziiertes Protein
-
Wikimedia Foundation.