- NADH
-
Strukturformel 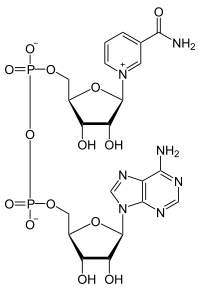
NAD+ (oxidierte Form)Allgemeines Name Nicotinamidadenindinukleotid Andere Namen - Nicotinsäureamid-Adenin -Dinukleotid
- Nadid (INN) (oxidierte Form, inneres Salz)
Summenformel - C21H27N7O14P2 (oxidierte Form, inneres Salz)
- C21H29N7O14P2 (reduzierte Form)
CAS-Nummer 53-84-9 (oxidierte Form, inneres Salz) PubChem 5892 Kurzbeschreibung farbloses, hygroskopisches Pulver (oxidierte Form, inneres Salz) [1] Eigenschaften Molare Masse - 663,43 g/mol (oxidierte Form, inneres Salz)
- 665,45 g/mol (reduzierte Form)
Aggregatzustand fest
Schmelzpunkt 140–142 °C (Zersetzung) (oxidierte Form, inneres Salz) [1]
Löslichkeit 10 g/l in Wasser [2]
Sicherheitshinweise Gefahrstoffkennzeichnung [3] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Nicotinamid-Adenin-Dinukleotid, eigentlich Nicotinsäureamid-Adenin-Dinukleotid (abgekürzt NAD) ist ein Hydridionen (Zwei-Elektronen/Ein-Proton) übertragendes Koenzym, das an zahlreichen Redoxreaktionen des Stoffwechsels der Zelle beteiligt ist.
Von der IUPAC/IUBMB werden die Abkürzungen NAD+ für die oxidierte Form, NADH für die reduzierte Form und NAD im Allgemeinen vorgeschlagen. Zuweilen findet man allerdings noch NAD statt NAD+ und NADH2 statt NADH.[1]
Das Coenzym wurde 1904 von Sir Arthur Harden und Young entdeckt (Harden- und Young-Ester) und war in der älteren Fachliteratur bis zu den frühen 60er Jahren des 20. Jahrhunderts auch unter der Bezeichnung Diphosphopyridinnucleotid, abgekürzt DPN, oder unter den Namen Codehydrase I bzw. Codehydrogenase I oder Coenzym I bekannt.[1]
Im Vergleich zum Nicotinamidadenindinukleotidphosphat (NADP+), einem sonst fast gleich gebauten Coenzym, hat NAD einen Phosphat-Rest am Adenosin weniger, NADP besitzt am 2'C-Atom der Ribose einen weiteren Phosphatrest.
Inhaltsverzeichnis
Chemie
NAD+ kann durch Aufnahme von zwei Elektronen (e−) und einem Proton (H+) zu NADH reduziert werden.
Biochemie
Funktion
NAD+ dient dem Organismus meist als Oxidationsmittel. Daher ist das Verhältnis NADH/NAD+ klein (<<1), um ein entsprechend positives Redoxpotential zu erzielen. Als Reduktionsmittel kommt aber vor allem NADPH zum Einsatz. Daher ist das Verhältnis NADPH/NADP+ groß (>>1), um zu einem entsprechend negativen Redoxpotential zu gelangen. Somit wird klar, warum es zwei differenzierbare Redoxcofaktoren geben muss. Ein einzelnes Redoxpaar könnte nicht gleichzeitig ein hohes Redoxpotential für biologische Oxidationen und ein niedriges Redoxpotential für biologische Reduktionen bereitstellen.
Die energiereiche, reduzierte Form NADH dient im oxidativen Stoffwechsel als energielieferndes Coenzym der Atmungskette, wobei ATP generiert wird. Bei ihrer Oxidation gibt sie die zuvor im katabolen Glucose- und/oder Fettstoffwechsel aufgenommenen Elektronen wieder ab und überträgt sie so im Rahmen der intrazellulären Knallgasreaktion auf Sauerstoff. Dabei entstehen schließlich NAD+ und Wasser.
NAD+ ist auch ein Koenzym von Dehydrogenasen, z. B. der Alkoholdehydrogenase (ADH), die Alkohol oxidieren.
Biosynthese
NAD+ wird im Körper sowohl aus Niacin (Nicotinsäure, Vitamin B3) oder Nicotinamid, als auch aus den Abbauprodukten der Aminosäure Tryptophan produziert. Da beide Ausgangsstoffe essenziell sind, sind Mangelerscheinungen möglich, aber durch die Redundanz beider Stoffwechselwege selten.
Knotenpunkt beider Reaktionswege ist Nicotinat-D-ribonukleotid, das direkt aus Niacin mithilfe der Nicotinat-Phosphoribosyltransferase gebildet werden kann, oder das aus dem Tryptophan-Abbauprodukt Chinolinsäure mittels des Enzyms Chinolinat-Phosphoribosyltransferase entsteht. Letztere Reaktion findet hauptsächlich in der Leber statt.[4]
An Nicotinat-D-ribonukleotid wird im nächsten Schritt Adenosinphosphat addiert. Diese Reaktion wird von der Nicotinamidnukleotid-Adenylyltransferase katalysiert, und es entsteht Deamido-NAD+. Dieses wird schließlich mithilfe der NAD-Synthase zu NAD+ aminiert.
Ein weiterer Syntheseweg beginnt mit Nicotinamid, das mit der Nicotinamid-Phosphoribosyltransferase zum Dinukleotid umgesetzt wird; dieses ist bereits ein Amid, so dass nur noch die Übertragung von Adenosinphosphat mit der o. g. Transferase notwendig ist, um NAD+ zu erhalten.
Die energiereiche, reduzierte Form NADH entsteht im Katabolismus (bei der Glykolyse und im Citratzyklus).
Optisch enzymatischer Test
NADH zeigt jeweils ein Absorptionsmaximum bei einer Wellenlänge von 260nm und 340 nm, NAD+ hingegen zeigt nur ein etwas höheres Absorptionsmaximum bei 260nm. Dies kann mittels Photometrie ausgenutzt werden, um enzymatische Reaktionen von Oxidoreduktasen/Dehydrogenasen zu verfolgen, die NAD+ oder NADH (oder deren phosphorylierten Äquivalente NADP+/NADPH als Kosubstrat verwenden. Da die Menge umgesetzten Substrats proportional zu der Menge des umgesetzten Kosubstrats ist, welche sich durch die Änderung der Absorption bei 340nm photometrisch verfolgen lässt (Berechnung der Konzentrationsänderung aus der Absorptionsänderung mittels Lambert-Beersches Gesetz), sind so indirekt quantitative Aussagen über die Menge an umgesetztem Substrat bzw. hergestelltem Produkt möglich, die, wollte man die Substrat- oder Produktkonzentration direkt verfolgen, nur sehr viel schwieriger möglich wären.
Absorptionseigenschaften
Das Nicotinamid-Adenin-Dinukleotid verfügt sowohl in seiner reduzierten (NADH) als auch in seiner oxidierten (NAD+) Form über einen identischen Adeninbereich (vgl. Strukturformel). Dieser absorbiert Licht bei einer Wellenlänge von 260 nm, dies erklärt das im Diagramm dargestellte, gemeinsame Absorptionsmaximum in dem Bereich 260 nm. Auffällig ist hier, dass bei gleicher Konzentration der Substanzen die Absorption des NAD+ in diesem Bereich höher ist als von NADH. Der Grund dafür ist, dass sich die Absorption des oxidierten, mesomeren Nikotinamidrings, der ebenfalls bei 260 nm absorbiert, mit der Absorption des Adenins überlagert und so für die erhöhte Absorption bei 260nm sorgt. Wird der Nikotinamidring reduziert, so entsteht ein chinoides System, das nun Licht mit einer Wellenlänge von 340 nm absorbiert. Dieser Unterschied zwischen NAD+ un NADH im UV Spektrum ermöglicht es, die Konversion zwischen oxidierten und reduzierten Form des Coenzyms in einem Spektrophotometer zu beobachten - beispielsweise in Enzym-Assays.
Einzelnachweise
- ↑ a b c d Thieme Chemistry (Hrsg.): Römpp Online. Version 3.1. Georg Thieme Verlag, Stuttgart 2007.
- ↑ Sicherheitsdatenblatt der Firma Merck
- ↑ Sicherheitsdatenblatt der Firma Carl Roth
- ↑ Fukuwatari T, Morikawa Y, Hayakawa F, Sugimoto E, Shibata K: Influence of adenine-induced renal failure on tryptophan-niacin metabolism in rats. In: Biosci. Biotechnol. Biochem.. 65, Nr. 10, October 2001, S. 2154–61. PMID 11758903
Weblinks
Wikimedia Foundation.


