- Glutaminolyse
-
Glutaminolyse steht für die Stoffwechsel-Umsetzungen zum Abbau der Aminosäure Glutamin zu Glutamat, Aspartat, CO2, Pyruvat, Lactat, Alanin und Citrat.
Inhaltsverzeichnis
Der glutaminolytische Stoffwechselweg
Die Glutaminolyse verwendet Reaktionsschritte des Citratzyklus und des Malat-Aspartat-Shuttle.
Reaktionsschritte von Glutamin zu α-Ketoglutarat
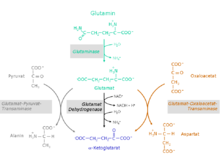
Die Umsetzung der Aminosäure Glutamin zu α-Ketoglutarat findet in zwei Reaktionsschritten statt.
Zunächst erfolgt eine Desaminierung von Glutamin unter Bildung von Glutamat und Ammonium durch das Enzym Glutaminase (EC 3.5.1.2). Danach wird Glutamat entweder von den Zellen ausgeschieden oder weiter zu α-Ketoglutarat verstoffwechselt werden. Die Umsetzung von Glutamat zu α-Ketoglutarat ist über drei unterschiedliche Stoffwechselwege möglich. Die beteiligten Enzyme sind
- Glutamatdehydrogenase (GlDH, EC 1.4.2.1)
- Glutamat-Pyruvat-Transaminase (GPT); Synonym: Alanin-Aminotransferase (ALT, ALAT, EC 2.6.1.2)
- Glutamat-Oxalacetat-Transaminase (GOT); Synonym: Aspartat-Aminotransferase (AST, ASAT, EC 2.6.1.1); eine Komponente des Malat-Aspartat-Shuttle
Rekrutierte Reaktionsschritte aus dem Citratzyklus und Malat-Aspartat-Shuttle
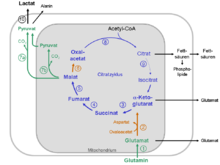 Glutaminolyse. Legende: blau = Reaktionsschritte des Citratzyklus; braun = Reaktionsschritte des Malat-Aspartat-Shuttle; grün = Enzyme, die in Tumoren überexprimiert sind. 1 = Glutaminase, 2 = GOT, 3 = α-Ketoglutarat Dehydrogenase, 4 = Succinat Dehydrogenase, 5 = Fumarase, 6 = Malat Dehydrogenase, 7a = cytosolisches malic enzyme, 7b = mitochondriales malic enzyme, 8 = Citrat Synthase, 9 = Aconitase, 10 = Lactate Dehydrogenase
Glutaminolyse. Legende: blau = Reaktionsschritte des Citratzyklus; braun = Reaktionsschritte des Malat-Aspartat-Shuttle; grün = Enzyme, die in Tumoren überexprimiert sind. 1 = Glutaminase, 2 = GOT, 3 = α-Ketoglutarat Dehydrogenase, 4 = Succinat Dehydrogenase, 5 = Fumarase, 6 = Malat Dehydrogenase, 7a = cytosolisches malic enzyme, 7b = mitochondriales malic enzyme, 8 = Citrat Synthase, 9 = Aconitase, 10 = Lactate Dehydrogenase
- α-Ketoglutarat + NAD+ + CoASH → Succinyl-CoA + NADH+H+ + CO2
Enzym: α-Ketoglutarat-Dehydrogenase-Komplex - Succinyl-CoA + GDP + Pi → Succinat + GTP
Enzym: Succinyl-CoA-Synthetase, EC 6.2.1.4 - Succinat + FAD → Fumarat + FADH2
Enzym: Succinat-Dehydrogenase, EC 1.3.5.1 - Fumarat + H2O → Malat
Enzym: Fumarase, EC 4.2.1.2 - Malat + NAD+ → Oxalacetat + NADH + H+
Enzym: Malat-Dehydrogenase, EC 1.1.1.37 (Komponente des Malat-Aspartat-Shuttle) - Oxalacetat + Acetyl-CoA + H2O → Citrat + CoASH
Enzym: Citrat-Synthase, EC 2.3.3.1
Reaktionsschritte von Malat zu Pyruvat und Lactat
Die Umsetzung von Malat zu Pyruvat und Lactat erfolgt über die beiden folgenden Reaktionsschritte:
- Malat + NAD(P)+ → Pyruvat + NAD(P)H + H+ + CO2
Enzym: NAD(P)-abhängige Malat-Decarboxylase (malic enzyme; EC 1.1.1.39 und 1.1.1.40) und - Pyruvat + NADH + H+ → Lactat + NAD+
Enzym: Lactat-Dehydrogenase (LDH; EC 1.1.1.27)
Intrazelluläre Kompartimentierung der Glutaminolyse
Die Reaktionsschritte der Glutaminolyse finden teilweise in den Mitochondrien und teilweise im Cytosol statt (siehe Stoffwechselschema).
Glutaminolyse: eine wichtige Energiequelle in Tumorzellen
Glutaminolyse findet in allen proliferierenden Zellen, wie zum Beispiel Lymphozyten, Thymozyten, Colonozyten, Adipozyten und insbesondere in Tumorzellen statt. In Tumorzellen ist der Citratzyklus aufgrund einer Hemmung des Enzyms Aconitase (EC 4.2.1.3) durch hohe Konzentrationen von Sauerstoffradikalen (reactive oxygen species (ROS)) trunkiert. Die Aconitase katalysiert die Umsetzung von Citrat zu Isocitrat. Auf der anderen Seite überexprimieren Tumorzellen die Phosphat-abhängige Glutaminase und die NAD(P)-abhängige Malat Decarboxylase, die gemeinsam in Kombination mit den verbleibenden Reaktionsschritten aus dem Citratzyklus die Erschließung einer neuen Energiequelle - den Abbau der Aminosäure Glutamin zu Glutamat, Aspartat, Pyruvat, CO2, Lactat, Alanin und Citrat ermöglichen.
In Tumorzellen ist die Glutaminolyse neben der Glycolyse eine weitere wichtige Quelle zur Energieregenerierung. Hohe Glutaminkonzentrationen stimulieren das Tumorwachstum und sind notwendig zur Zelltransformation. Entsprechend korreliert eine Reduzierung der Glutamin-Konzentration mit einer phänotypischen und funktionellen Differenzierung der Zellen.
Energie-Ausbeute der Glutaminolyse in Tumorzellen
- ein Adenosintriphosphat (ATP) durch direkte Phosphorylierung von GDP
- zwei ATP durch Oxidation von FADH2
- drei ATP pro NADH+ H+, aus der α-Ketoglutarat-Dehydrogenase-Reaktion, der Malat-Dehydrogenase-Reaktion und der Malat-Decarboxylase-Reaktion.
In Tumorzellen sind die Aktivitäten der Glutamat-Pyruvat-Transaminase und der Glutamat-Dehydrogenase sehr niedrig. Aus diesem Grund findet in Tumorzellen die Umsetzung von Glutamat zu α-Ketoglutarat überwiegend über die von der Glutamat-Oxaloacetate-Transaminase katalysierten Reaktion statt.
Vorteile der Glutaminolyse für Tumorzellen
- Glutamin kommt in allen Geweben in hohen Konzentrationen vor und ist eine effiziente zusätzliche Energiequelle, insbesondere wenn die glycolytische Energie-Produktion durch einen hohen Anteil an Tumor M2-PK (dimere Form der M2-PK) reduziert ist.
- Glutamin und seine Abbauprodukte Glutamat und Aspartat sind wichtige Ausgangsstoffe für die Nukleinsäure- und Serin-Synthese.
- Die Glutaminolyse ist insensitiv gegenüber hohen ROS-Konzentrationen.
- Aufgrund der Trunkierung des Citratzyklus ist der Anteil an Acetyl-CoA, das in den Citratzyklus eingeschleust wird gering und Acetyl-CoA steht zur Neusynthese von Fettsäuren und Cholesterin zur Verfügung. Die Fettsäuren können zur Phospholipid-Synthese verwendet werden oder von den Zellen nach außen abgegeben werden.
- Fettsäuren sind reich an Wasserstoff. Aus diesem Grund ist die Abgabe von Fettsäuren ein effizienter Weg der Zelle den in der glycolytischen Glycerinaldehyd-3-phosphat-Dehydrogenase (GAPDH; EC 1.2.1.9) Reaktion gebildeten Wasserstoff aus den Zellen zu entfernen.
- Glutamat und Fettsäuren zeigen immunosuppressive Wirkungen. Es ist deshalb denkbar, dass die Abgabe von Glutamat und Fettsäuren Tumorzellen vor Angriffen durch das Immunsystem schützt.
- Es wird weiterhin diskutiert, dass der Glutamatpool die endergonische Aufnahme von anderen Aminosäuren durch das ASC-System unterstützt.
Siehe auch
Quellen
- Krebs HA and Bellamy D: The interconversion of glutamic acid and aspartic acid in respiring tissues. Biochem. J. (1960); 75: 523-529. PMID 14411856
- Reitzer LJ, Wice BM and Kennell D: Evidence that glutamine, not sugar, is the major energy source for cultured HeLa-cells. J. Biol. Chem. (1979); 254: 2669-2676. PMID 429309
- Zielke HR, Sumbilla CM, Sevdalian DA, Hawkins RL and Ozand PT: Lactate: a major product of glutamine metabolism by human diploid fibroblasts. J. Cell. Physiol. (1980); 104: 433-441. PMID 7419614
- Mc Keehan WL: Glycolysis, glutaminolysis and cell proliferation. Cell Bio. Int. Rep. (1982); 6: 635-650. PMID 6751566
- Parlo RA and Coleman PS: Enhanced rate of citrate export from cholesterol-rich hepatoma mitochondria. The truncated Krebs cycle and other metabolic ramifications of mitochondrial membrane cholesterol. J. Biol. Chem. (1984); 259: 9997-10003. PMID 6469976
- Zielke HR, Zielke CL and Ozand PT: Glutamine: a major energy source for cultured mammalian cells. Fed. Proc. (1984); 43: 121-125. PMID 6690331
- Eigenbrodt E, Fister P, Reinacher M: New perspectives on carbohydrate metabolism in tumor cells. In: Regulation of Carbohydrate Metabolism, CRC Press, Boca Raton, Fl (1985); 2: 141-179. ISBN 0-8493-5263-0
- Lanks KW: End products of glucose and glutamine metabolism by L929 cells. J. Biol. Chem. (1987); 262: 10093-10097. PMID 3611053
- Brand K, Fekl W, von Hintzenstern J, Langer K, Luppa P and Schoerner C: Metabolism of glutamine in lymphocytes. Metabolism (1989); 38: 29-33. PMID 2569663
- Eck HP, Drings P and Dröge W: Plasma glutamate levels, lymphocyte reactivity and death in patients with bronchial carcinoma. J. Cancer Res. Clin. Oncol. (1989); 115: 571-574. PMID 2558118
- Vaupel P, Kallinowski F and Okunieff P: Blood flow, oxygen and nutrient supply, and metabolic microenvironment of human tumors. Cancer Res. (1989); 49: 6449-6465. PMID 2684393
- Board M, Humm S and Newsholme EA: Maximum activities of key enzymes of glycolysis, glutaminolysis, pentose phosphate pathway and tricarboxylic acid cycle in normal, neoplastic and suppressed cells. Biochem. J. (1990); 265: 503-509. PMID 2302181
- Medina MA and Núñez de Castro I: Glutaminolysis and glycolysis interactions in proliferant cells. Int. J. Biochem. (1990); 22: 681-683. PMID 2205518
- Matsuno T: Pathway of glutamate oxidation and its regulation in HuH13 line of human hepatoma cells. J. Cell. Physiol. (1991); 148: 290-294. PMID 1679060
- Matsuno T and Goto I: Glutaminase and glutamine synthetase activities in human cirrhotic liver and hepatocellular carcinoma. Cancer Res. (1992); 52: 1192-1194. PMID 1346587
- Aledo JC, Segura JA, Medina MA, Alonso FJ, Núñez de Castro I and Marquez J: Phosphate-activated glutaminase expression during tumor development. FEBS Lett. (1994), 341: 39-42. PMID 8137919
- Grimm H, Tibell A, Norrlind B, Blecher C, Wilker S, and Schwemmle K: Immunoregulation by parental lipids: impact of the n-3 to n-6 fatty acid ratio J. Parenter. Enteral. Nutr. (1994); 18: 417-421. PMID 7815672
- Turowski GA, Rashid Z, Hong F, Madri JA and Basson MD: Glutamine modulates phenotype and stimulates proliferation in human colon cancer cell lines. Cancer Res. (1994); 54: 5974-5980. PMID 7954430
- Gardner PR, Raineri I, Epstein LB and White CW: Superoxide radical and iron modulate aconitase activity in mammalian cells. J. Biol. Chem. (1995); 270: 13399-13405. PMID 7768942
- Goossens V, Grooten J and Fiers W: The oxidative metabolism of glutamine. A modulator of reactive oxygen intermediate-mediated cytotoxicity of tumor necrosis factor in L929 fibrosarcoma cells. J. Biol. Chem. (1996); 271: 192-196. PMID 8550558
- Mazurek S, Hugo F, Failing K and Eigenbrodt E: Studies on associations of glycolytic and glutaminolytic enzymes in MCF-7 cells: role of p36. J. Cell. Physiol. (1996); 167: 238-250. PMID 8613464
- Mazurek S, Michel A and Eigenbrodt E: Effect of extracellular AMP on cell proliferation and metabolism of breast cancer cell lines with high and low glycolytic rates. J. Biol. Chem. (1997); 272: 4941-4952. PMID 9030554
- Spittler A, Oehler R, Goetzinger P, Holzer S, Reissner CM, Leutmezer J, Rath V, Wrba F, Fuegger R, Boltz-Nitulescu G and Roth E: Low glutamine concentrations induce phenotypical and functional differentiation of U937 myelomonocytic cells. J. Nutr. (1997); 127: 2151-2157. PMID 9349841
- Eigenbrodt E, Kallinowski F, Ott M, Mazurek S and Vaupel P: Pyruvate kinase and the interaction of amino acid and carbohydrate metabolism in solid tumors. Anticancer Res. (1998); 18: 3267-3274. PMID 9858894
- Jiang WG, Bryce RP and Hoorobin DF: Essential fatty acids: molecular and cellular basis of their anti-cancer action and clinical implications. Crit. Rev. Oncol. Hematol. (1998); 27: 179-209. PMID 9649932
- Piva TJ and McEvoy-Bowe E: Oxidation of glutamine in HeLa cells: role and control of truncated TCA cycles in tumour mitochondria. J. Cell Biochem. (1998); 68: 213-225. PMID 9443077
- Mazurek S, Eigenbrodt E, Failing K and Steinberg P: Alterations in the glycolytic and glutaminolytic pathways after malignant transformation of rat liver oval cells. J. Cell. Physiol. (1999); 181: 136-146. PMID 10457361
- Lobo C, Ruiz-Bellido MA, Aledo JC, Marquez J, Núñez De Castro I and Alonso FJ: Inhibition of glutaminase expression by antisense mRNA decreases growth and tumourigenicity of tumour cells. Biochem. J. (2000); 348: 257-261. PMID 10816417
- Mazurek S, Grimm H, Oehmke M, Weisse G, Teigelkamp S and Eigenbrodt E: Tumor M2-PK and glutaminolytic enzymes in the metabolic shift of tumor cells. Anticancer Res. (2000); 20: 5151-5154. PMID 11326687
- Kim KH, Rodriguez AM, Carrico PM and Melendez JA: Potential mechanisms for the inhibition of tumor cell growth by manganese superoxide dismutase. Antioxid. Redox. Signal. (2001) 3: 361-373. PMID 11491650
- Mazurek S, Zwerschke W, Jansen-Dürr P and Eigenbrodt E: Effects of the human papilloma virus HPV-16 E7 oncoprotein on glycolysis and glutaminolysis: role of pyuvate kinase type M2 and the glycolytic enzyme complex. Biochem. J. (2001); 356: 247-256. PMID 11336658
- Mazurek S, Grimm H, Boschek CB, Vaupel P and Eigenbrodt E: Pyruvate kinase type M2: a crossroad in the tumor metabolome. Brit. J. Nutr. (2002); 87: S23-S29. PMID 11895152
- Aledo JC: Glutamine breakdown in rapidly dividing cells: waste or investment ? Bioessays (2004); 26, 778-785. PMID 15221859
- Rossignol R, Gilkerson R, Aggeler R, Yamagata K, Remington SJ and Capaldi RA: Energy substrate modulates mitochondrial structure and oxidative capacity in cancer cells. Cancer Res. (2004); 64: 985-993. PMID 14871829
- Elchuri S, Oberley TD, Qi W, Eisenstein RS, Jackson Roberts L, van Remmen H, Epstein CJ and Huang TT: CuZnSOD deficiency leads to persistent and widespread oxidative damage and hepatocarcinogenesis later in life. Oncogene (2005); 24: 367-380. PMID 15531919
- Mazurek S: Tumor cell energetic metabolome. In: Molecular System Bioenergetics (Saks, V ed.) Wiley-VCH, Weinheim, Germany (2007): pp 521-540. ISBN 978-3-527-31787-5
Weblinks
Wikimedia Foundation.