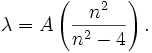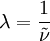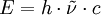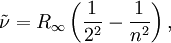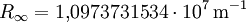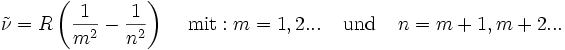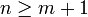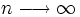- H-α
-
Als Balmer-Serie wird die Folge von Spektrallinien im (elektronischen) Spektrum des Wasserstoffatoms bezeichnet, die beim Übergang eines Elektron von einem höheren zum zweittiefsten Energieniveau emittiert wird.
Inhaltsverzeichnis
Entdeckung der Balmer-Linien
Im sichtbaren Bereich des Wasserstoffatom-Spektrums lassen sich vier Linien beobachten. Ihr Abstand nimmt mit der Wellenlänge ab. Sie werden, beginnend mit der größten Wellenlänge, mit Hα, Hβ, Hγ und Hδ bezeichnet. Im Jahr 1885 entdeckte der Schweizer Johann Jakob Balmer, dass sich die Wellenlänge dieser Linien mit der einfachen Gleichung berechnen lässt:
In dieser Gleichung ist A eine rein empirische Konstante (A = 3645,6 × 10-10 m = 3645,6 Å), und für n sind die ganzen Zahlen 3, 4, 5 und 6 einzusetzen, wobei n die fortlaufende Nummer der Schale eines Atoms laut dem Bohrschen Atommodell bezeichnet. Im Ultravioletten, dem für das menschliche Auge nicht sichtbaren Bereich des Spektrums, wurden weitere Linien entdeckt. Diese werden fortlaufend mit Hε, Hζ usw. bezeichnet. Die experimentell bestimmte Wellenlänge dieser Linien stimmt mit den rechnerischen Werten aus der Balmergleichung für ganzzahlige n größer 6 ebenfalls sehr gut überein.
Übersicht Übergang von n 3 → 2 4 → 2 5 → 2 6 → 2 7 → 2 8 → 2 9 → 2 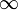 → 2
→ 2Name H-α H-β H-γ H-δ H-ε H-ζ H-η Wellenlänge in nm 656,3 486,1 434,1 410,2 397,0 388,9 383,5 364,6 Farbe Rot Blau-Grün Violett Violett Violett Violett Ultraviolett Ultraviolett Verallgemeinerung durch Rydberg
Die Wellenzahl lässt sich durch die Beziehung
in die Wellenlänge bzw. durch
in die entsprechende Photonenenergie umrechnen. In der letzten Gleichung sind c die Lichtgeschwindigkeit im Vakuum und h die Plancksche Konstante.
Mit dieser Beziehung zwischen Wellenlänge und Wellenzahl sowie
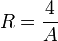 lässt sich die von Balmer gefundene Gleichung schreiben:
lässt sich die von Balmer gefundene Gleichung schreiben:dabei ist
die nach dem schwedischen Physiker Johannes Rydberg benannte Rydberg-Konstante. Für n sind ganze Zahlen größer als 2 einzusetzen.
Bereits 1890 verallgemeinerte Johannes Rydberg die Gleichung von Balmer zur Rydberg-Formel :
Bis zu diesem Zeitpunkt waren im Wasserstoffspektrum nur Linien für m = 2 bekannt, das heißt, seine Gleichung war eine Voraussage für noch nicht gefundene Linien! Die Entdeckung einer neuen Serie für m = 1 durch den US-amerikanischen Physiker Theodore Lyman im Jahr 1906 bestätigte Rydbergs Erweiterung.
Ritzsches Kombinationsprinzip
Die Gleichung von Rydberg beschreibt das Wasserstoffspektrum recht genau. Bei den meisten anderen Atomen liefert sie jedoch keine korrekten Ergebnisse. Einen Fortschritt in der Beschreibung der Atomspektren lieferte im Jahr 1908 der Schweizer Mathematiker Walter Ritz. Er entdeckte das nach ihm benannte Ritzsche Kombinationsprinzip: „Durch additive oder subtraktive Kombination, sei es der Serienformeln selbst, sei es der in sie eingehenden Konstanten, lassen sich andere Serienformeln bilden.“ Vereinfacht ausgedrückt bedeutet dies, dass sich durch zwei bekannte Linien eine mögliche dritte Linie berechnen lässt. Jedoch nicht alle dieser damit berechneten Linien lassen sich beobachten. Welche Linien auch wirklich auftreten, konnte Ritz nicht erklären.
Deutung durch das Bohrsche Atommodell
Die bis zu diesem Zeitpunkt rein empirisch gefundenen Formeln ließen sich erstmals mit dem Bohrschen Atommodell verstehen. Danach sind die Spektrallinien auf den Übergang von Elektronen auf ein anderes Energieniveau zurückzuführen. Mit dem Modell von Bohr erhält man als allgemeine Gleichung für diese Übergänge:
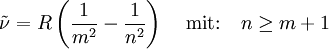 .
.
Das erste Glied in der Klammer, 1/m2, ist der so genannte Grundterm. Das zweite, 1/n2, wird als Laufterm bezeichnet. Hält man m im Grundterm fest und variiert n im Laufterm, ergeben sich die unten aufgeführten, nach ihren Entdeckern benannten Serien. Mit Ausnahme von Hα (rot), Hβ (blaugrün), Hγ, Hδ, Hε und Hζ (alle violett) liegen sie im ultravioletten bzw. infraroten Bereich des Frequenzspektrums.
Name m n Formel Farbe Lyman-Serie 1 2, 3, 4, … 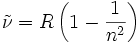
Vakuum-UV (121 nm→ 91 nm) Balmer-Serie 2 3, 4, 5, … 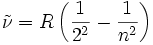
rot, blaugrün, 4× violett,
dann Übergang zum nahen UV → 365 nmPaschen-Serie 3 4, 5, 6, … 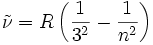
IR-A (1875 nm → 820 nm) Brackett-Serie 4 5, 6, 7, … 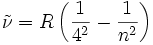
IR-B (4050 nm → 1460 nm) Pfund-Serie 5 6, 7, 8, … 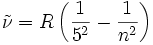
IR-B (7457 nm → 2280 nm) Bereits im Bohrschen Atommodell ist, im Gegensatz zur Balmerformel, die Konstante keine rein empirische Größe. Vielmehr lässt sich der Wert direkt auf in die Rechnung eingehende Naturkonstanten zurückführen. Der Index deutet dabei an, dass die Bewegung von Atomkern und Elektron um den gemeinsamen Schwerpunkt berücksichtigt wurde. Auch die Einschränkung auf ganzzahlige Werte für m und n sowie die Bedingung
folgt aus diesem Modell. Die Variablen sind danach Quantenzahlen; m bzw. n sind die Hauptquantenzahlen für jenen Grund- oder angeregten Zustand, auf denen das Elektron zurückfällt, bzw. den höherenergetischen, darüber hinaus angeregten Zustand n, von welchem es verfällt (d.h. ein Übergang zwischen Elektronen ist im Allgemeinen - wie bei der Balmer-Serie - auch zwischen zwei angeregten Zuständen möglich).
Die Abbildung zeigt das Termschema des Wasserstoffatoms und visualisiert die obigen Gleichungen: Auf der linken vertikalen Achse ist m abgetragen. Auf der rechten vertikalen Achse ist die zugehörige Anregungsenergie, jeweils vom Grundzustand aus gemessen, in eV angegeben. Der Abstand der Energieniveaus ist maßstabsgerecht. In horizontaler Richtung sind für jede Serie exemplarisch die ersten Übergänge eingezeichnet. Die zugehörigen Hauptquantenzahlen des Zustandes n sind in kursiver Schrift darüber angegeben. Der Abstand der Linien zueinander, d.h. in horizontaler Richtung, ist nicht maßstabsgerecht, sondern aus Gründen der Übersichtlichkeit gleich groß gewählt. Die Abbildung verdeutlicht, dass alle Linien einer Serie auf dem gleichen Energieniveau enden. Die Hα-Linie der Balmer-Serie ist somit ein Übergang von n = 3 nach m = 2.
Ganz rechts in den Serien ist gepunktet die jeweilige Seriengrenze d.h.
dargestellt. Das Elektron ist dann nicht mehr an dem Atomkern gebunden, das Atom ist ionisiert. Für die Lyman-Serie erhält man mit der Bohrschen Gleichung eine Energie von 13,6 eV. Auch dieser Wert stimmt mit dem experimentell bestimmten Wert für die Ionisationsenergie des Wasserstoffatoms im Grundzustand gut überein.
Die Frage, welche der Linien, die nach dem Ritzschen Kombinationsprinzip möglich sind, auch tatsächlich auftreten, wird durch die Auswahlregeln geklärt. Diese ergeben sich aus quantenmechanischen Rechnungen.
→ Siehe auch: Nebulium
Literatur
- Johann Jakob Balmer: Notiz über die Spectrallinien des Wasserstoffs. Wiedemann's Annalen der Physik und Chemie, NF. Band 25. S. 80-87.
Weblinks
- Termschema von Wasserstoff - Balmer-Serie - dargestellt in einer Animation
Weitere Serien sind:
Wikimedia Foundation.