- Hexafluoraceton
-
Strukturformel 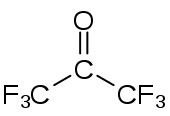
Allgemeines Name Hexafluoraceton Andere Namen - HFA
- Perfluroraceton
- Hexafluoro-2-propanone
Summenformel - C3F6O
- C6H6F12O5 (Sesquihydrat)
CAS-Nummer - 684-16-2
- 13098-39-0 (Sesquihydrat)
PubChem 3032602 Kurzbeschreibung farblose Flüssigkeit (Sesquihydrat)[1]
Eigenschaften Molare Masse Aggregatzustand - gasförmig
- flüssig (Sesquihydrat)
Dichte Schmelzpunkt Siedepunkt −26 °C[2]
Dampfdruck Löslichkeit löslich in Wasser[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [2] 



Gefahr
H- und P-Sätze H: 280-301-311-314-330-360 EUH: keine EUH-Sätze P: 201-260-280-284-301+310-305+351+338 [2] EU-Gefahrstoffkennzeichnung [2] 
Giftig (T) R- und S-Sätze R: 60-63-14-23/24/25-34 S: 7/9-26-28-36-45 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Hexafluoraceton (HFA) ist ein Derivat des Acetons, bei dem alle Wasserstoffatome durch Fluor ersetzt sind. Als Feinchemikalie ist es im Handel als Sesquihydrat, also mit formal 1,5 Wassermolekülen pro Molekül. Es dient als Baustein bei der Synthese fluorhaltiger organischer Verbindungen. So werden durch Umsetzung mit Aromaten Vernetzungsmittel für Kautschuke sowie Monomere für die Herstellung von Polyamiden erzeugt.[3] Weiterhin findet das Deutero-Hydrat als NMR-Lösungsmittel und als Reagenz in der Schutzgruppen-Technik Verwendung.
Inhaltsverzeichnis
Herstellung
Zur Herstellung von Hexafluoraceton wird technisch zumeist die Isomerisierung von Hexafluor-1,2-epoxypropan gewählt. So erhält man es durch Umsetzung in Gegenwart von lewis-sauren Katalysatoren wie Al2O3, TiO2, WO2, AlCl3, AlBr3, SnCl4, VOCl3, TiCl4, FeCl3, CuCl2 oder ZrOCl2.[4]
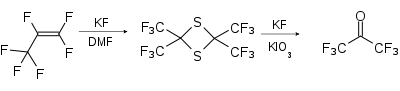
Eine Labormethode beruht auf der Umsetzung von Perfluorpropen mit Schwefel und Kaliumfluorid und anschließender Ringöffnung des Dithietans mit Kaliumfluorid und Kaliumiodat zum HFA.[5]
Eigenschaften
Im Hexafluoraceton ist das Carbonyl-Kohlenstoffatom durch seine benachbarten Trifluormethyl-Reste sehr elektronenarm und daher gegenüber Nucleophilen wie selbst Aromaten oder Olefinen reaktionsfähig. Mit Wasser bilden sich stabile Hydrate. Analog reagiert HFA mit Ammoniak zu den entsprechenden Halbaminalen (CF3)2C(OH)(NH2), deren Dehydatisierung mit Phosphoroxichlorid (POCl3) das Hexafluor-2-propylimin (CF3)2CNH liefert.[6]
Da HFA keine zur Carbonylgruppe benachbarten Wasserstoffatome hat, zeigt es kein zur Keto-Enol-Tautomerie vergleichbares Verhalten.
Verwendung
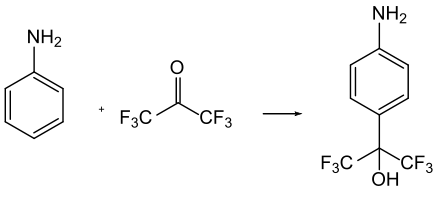
Eine Bedeutung hat HFA als elektrophiles Reagenz für die Substitution an Aromaten. So reagiert es meist in Gegenwart von Säuren zu den entsprechenden Hexafluor-2-hydroxy-2-aryl-verbindungen, die als Zwischenprodukte in der Wirkstoffsynthese dienen.[7]
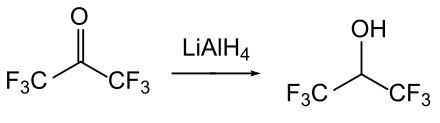
Das Hydroperoxyd des HFA, also das Wasserstoffperoxid-Addukt, ist ein potentes Epoxidierungsmittel.[8]Die Reduktion von HFA mit Lithiumaluminiumhydrid oder Natriumborhydrid liefert das wichtige Lösungsmittel Hexafluor-2-propanol.
Einzelnachweise
- ↑ a b c d e Datenblatt Hexafluoraceton bei Merck, abgerufen am 9. März 2010..
- ↑ a b c d e f g Datenblatt Hexafluoroacetone bei Sigma-Aldrich, abgerufen am 3. April 2011.
- ↑ C. G. Krespan, W. J. Middleton: "Fluorine", in: Chem. Rev., 1967, 1, S. 145.
- ↑ U.S.-Patent 3.321.515.
- ↑ M. Van Der Puy, Louis G. Anello, in: Org. Synth., Coll. Vol. 7, 1990, S. 251.
- ↑ W. J. Middleton, H. D. Carlson: "Hexafluoroacetoneimine", in: Org. Synth., Coll. Vol. 6, 1988, S. 664.
- ↑ H. Hacklin: Phosphorinane: Synthesen, Eigenschaften und Verhalten gegenüber Hexafluoraceton, Universität Bremen, Dissertations Druck, Darmstadt, 1987.
- ↑ W. Adam, et al, in: Chem. Rev., 2001, 101, S. 3499.
Kategorien:- Giftiger Stoff
- Stoff mit reproduktionstoxischer Wirkung
- Stoff mit Verdacht auf reproduktionstoxische Wirkung
- Fluoralkan
- Keton
Wikimedia Foundation.