- Hydroxyphenylessigsäure
-
Strukturformel 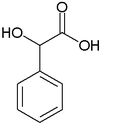
Allgemeines Name Mandelsäure Andere Namen - Hydroxyphenylessigsäure
- Phenylglykolsäure
- (RS)-Mandelsäure
- (R)-Mandelsäure
- (S)-Mandelsäure
- DL-Mandelsäure
- D-Mandelsäure
- L-Mandelsäure
Summenformel C8H8O3 CAS-Nummer - 90-64-2 [(RS)-Mandelsäure]
- 611-71-2 [(R)-Mandelsäure]
- 17199-29-0 [(S)-Mandelsäure]
Kurzbeschreibung Feststoff Eigenschaften Molare Masse 152,15 g·mol−1 Aggregatzustand fest
Dichte 1,3 g·cm-3 [1]
Schmelzpunkt Löslichkeit löslich in Wasser (158,7 g·l−1 bei 20 °C[1]), Ether und Alkohol
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 
Reizend (Xi) R- und S-Sätze R: 41 S: 26-39 LD50 300 mg·kg−1 (Ratte, intramuskulär) [3]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Die Mandelsäure (α-Hydroxyphenylessigsäure) ist eine aromatische Carbonsäure, die aufgrund des asymmetrischen α-C-Atoms zwei Enantiomere ausbildet, die D(−)- und L(+)-Mandelsäure [Synonyme: (R)- und (S)-Mandelsäure]. Das racemische Gemisch (Racemat) der DL-Mandelsäure [Synonym: (RS)-Mandelsäure] liegt als weißer, kristalliner Feststoff vor.
Entdeckt wurde die Mandelsäure beim Erhitzen eines Extrakts bitterer Mandeln mit verdünnter Salzsäure. Industriell wird Mandelsäure aus Benzaldehyd und Blausäure gewonnen, um anschließend in verschiedenen Medikamenten weiterverarbeitet zu werden.
Mandelsäure wirkt in saurem Milieu auf Streptokokken, Staphylokokken und Colibakterien bakteriostat bzw. bakteriozid.
Die Mandelsäure findet Verwendung in der arbeitsmedizinischen Diagnostik beim beruflichen Umgang mit Styrol (Kunststoffproduktion). Zu hohe Styrolbelastungen in der Atemluft schlagen sich als hohe Mandelsäure-Werte im Urin nieder.[4]
(R)- oder (S)-Mandelsäure findet auch Verwendung bei asymmetrischen Aldolreaktionen und dient dabei als chiraler Ligand.[5] (R)-Mandelsäure bildet mit racemischen Aminen diastereomere Salze, die häufig durch fraktionierende Kristallisation getrennt werden können. Daraus kann dann das jeweilige enantiomerenreine Amin durch Zugabe einer Base erhalten werden. Nach dieser Methode ist beispielsweise die Racematspaltung des Arzneistoffes (RS)-Penbutolol gelungen.[6] (S)-Mandelsäure kann ebenso als Reagenz zur Racemattrennung racemischer Amine eingesetzt werden.
Quellen
- ↑ a b c Sicherheitsdatenblatt der Firma Alfa Aesar
- ↑ The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage, 2006, S. 989, ISBN 978-0-911910-00-1.
- ↑ Mandelic acid bei ChemIDplus
- ↑ www.uni-duesseldorf.de
- ↑ R. Mahrwald, Org. Lett. 2000, 2, 4011–4012.
- ↑ Hermann J. Roth, Christa E. Müller und Gerd Folkers: Stereochemie & Arzneistoffe, Wissenschaftliche Verlagsgesellschaft Stuttgart, 1998, ISBN 3-8047-1485-4, S. 164-165.
Weblinks
Wikimedia Foundation.

