- Styrol
-
Strukturformel 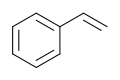
Allgemeines Name Styrol Andere Namen - Styren
- Phenylethen
- Vinylbenzol
Summenformel C8H8 CAS-Nummer 100-42-5 PubChem 7501 Kurzbeschreibung farblose, süßlich riechende stark lichtbrechende Flüssigkeit[1][2]
Eigenschaften Molare Masse 104,15 g·mol−1 Aggregatzustand flüssig
Dichte 0,91 g·cm−3[1]
Schmelzpunkt Siedepunkt 145 °C[1]
Dampfdruck Löslichkeit - sehr schlecht in Wasser (320 mg·l−1 bei 20 °C)[1]
- gut in Diethylether, Aceton, Kohlenstoffdisulfid, Methanol und Ethanol[2]
Brechungsindex 1,5458[2]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [3] 

Achtung
H- und P-Sätze H: 226-332-319-315 EUH: keine EUH-Sätze P: 210-241-302+352-303+361+353-305+351+338-501 [1] EU-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [3] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 10-20-36/38 S: (2)-23 MAK 20 ml·m−3, 86 mg·m−3[1]
LD50 2000–5000 mg·kg−1 (Ratte, peroral)[2]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C Styrol (auch Vinylbenzol, Styren, nach der IUPAC-Nomenklatur Phenylethen) ist eine farblose, niedrigviskose (0,7 mPa·s20 °C), süßlich riechende Flüssigkeit. Sie dient vor allem zur Herstellung von Kunststoffen wie dem Polystyrol und ABS. Die Flüssigkeit polymerisiert schon bei Raumtemperatur und hat außergewöhnliche Polymerisationseigenschaften. Styrol gehört zu den Arenen, also den aromatischen Kohlenwasserstoffen. Styrol ist entzündlich und gesundheitsschädlich.
Inhaltsverzeichnis
Geschichte
Der Berliner Apotheker Eduard Simon erwarb um 1835 Styrax, das Harz des Orientalischen Amberbaumes (Liquidambar orientalis), der in Vorderasien wächst. Dieses Baumharz wurde schon bei den alten Ägyptern Parfüms und Heilmitteln beigemengt. Bei der Destillation dieses Baumwachses entdeckte er eine farblose Flüssigkeit und benannte sie nach dem Ausgangsstoff Styrol. Als er die Flüssigkeit erwärmte, bildete sich ein neuer Stoff. Er nahm an, dass es sich um Styroloxid handelte. Der englische Chemiker John Blyth und der deutsche Chemiker August Wilhelm von Hofmann fanden jedoch 1845 durch Elementaranalyse heraus, dass sich die Stoffzusammensetzung nicht verändert hatte. Marcellin Berthelot deutete die Veränderung bei der Erwärmung 1866, völlig richtig, als Polymerisation. Hermann Staudinger, der sich hauptsächlich mit der Polymerchemie befasste, beschrieb schließlich in Thesen, dass durch die Erwärmung eine Kettenreaktion gestartet wird, bei der die Makromoleküle des Polystyrols entstehen.
Ungefähr um 1930 begann die Entwicklung von technischen Verfahren zur Styrolherstellung. Vorher musste es aus dem Crackbenzin isoliert werden. Während des Zweiten Weltkrieges stieg der Bedarf, weil es für das Styrol-Butadien-Copolymer benötigt wurde. Nach dem Zweiten Weltkrieg wurde es dann in größeren Mengen synthetisch hergestellt, weil eine hohe Nachfrage nach Polystyrol vorlag.
Vorkommen
Styrol kommt in geringen Mengen im Styrax (Baumharz), im Steinkohlenteer und in Pyrolyseprodukten des Erdöls vor (ungefähr 7 % im Crackbenzin). In den letzten beiden Jahrzehnten ist eine Zunahme der Styrolemissionen durch vermehrten Einsatz von Styrol-Kunststoffen zu verzeichnen. Styrol ist in der Natur ein Aromatstoff und kommt zum Beispiel in kleinen Mengen in Weintrauben und Kiwis vor, auch im Duft der Orchideenblüten ist es enthalten. Über die Wirkung ist wenig bekannt, wahrscheinlich dient es der Anlockung von Bestäubern im Falle der Blüten oder Konsumenten zur Samenverteilung bei den Früchten.
Gewinnung und Darstellung
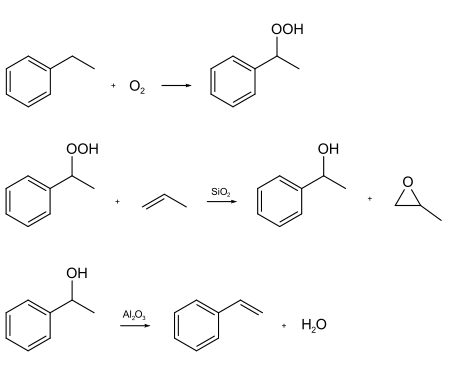
Es gibt gegenwärtig zwei Verfahren zur Styrolherstellung mit technischer Bedeutung. Bei der indirekten Propenoxidation (SM/PO-Verfahren = Styrene Monomer & Propylene Oxide) wird Ethylbenzol bei ungefähr 2 bar und 150 °C zu Ethylbenzolhydroperoxid peroxidiert. Das Ethylbenzolhydroperoxid epoxidiert Propen bei hohem Druck und 115 °C an Siliciumdioxid zu Propylenoxid. Hierbei entsteht 1-Phenylethanol. Dieses wird bei circa 200 °C über Aluminiumoxid zu Styrol dehydratisiert. In Deutschland werden nur etwa 10 % des hergestellten Styrols durch dieses Verfahren hergestellt.
Das zweite Verfahren ist die katalytische Dehydrierung. Bei 600 °C bis 650 °C und in Anwesenheit eines Katalysators (Eisen(II,III)-oxid, Kaliumhydroxid) wird Ethylbenzol dehydriert. Um die Effizienz zu steigern, wird hierbei der Druck verringert oder bei der Reaktion Wasserdampf eingesetzt. Dieses Verfahren ist weitaus bedeutender.
1996 betrug die jährliche Weltproduktion von Styrol 19,2 Millionen Tonnen.
Eigenschaften
Styrol riecht angenehm süßlich, die Geruchsschwelle liegt zwischen 0,43 und 866 mg·m−3 (Gemäß Stoffmerkblatt: 0,02–3,4 mg·m−3). In Wasser (0,03 g/100 ml) ist es nur sehr begrenzt löslich, in Aceton, Ether, Kohlenstoffdisulfid, Dichlormethan, und Alkohol ist es gut löslich. Styrol polymerisiert schon bei Raumtemperatur zu einer gelben, klebrigen Flüssigkeit, deshalb wird sie mit bis zu 50 ppm von 4-tert-Butylcatechol oder auch Hydrochinon stabilisiert. Die Stabilisatoren wirken aber nur in Anwesenheit von geringen Mengen Sauerstoff, da sie zunächst als Antioxidationsmittel wirken, die bei der Oxidation der Stabilisatoren entstehenden Produkte wirken dann als Inhibitoren. Bei Licht-, Sauerstoff- oder Wärmeeinwirkung kommt es zu einer deutlichen Beschleunigung der Polymerisation, daher wird es in dunklen Gläsern und an kühleren Orten gelagert. Styrol bricht das Licht mit einem Brechungsindex von 1,5458 noch stärker als das Benzol. Der Flammpunkt liegt bei 31 °C, die Zündtemperatur bei 490 °C.
Reaktionen
Das Reaktionsverhalten des Styrols ist von der Konkurrenz der Vinylgruppe und dem aromatischen Ring geprägt. Daher reagiert es in vielen Fällen anders als zum Beispiel Benzol. Einige Elektrophile, die zu Additionsreaktionen neigen, und auch Radikale greifen bevorzugt an der Vinylgruppe an, da dort im Übergangszustand der Reaktion kein aromatischer Zustand aufgehoben werden muss, wie dies beim Angriff am Ring der Fall ist. Typische elektrophile Substitutionsreagenzien, die üblicherweise nicht an Alkene addieren, substituieren das Styrol am Ring. Beispiele hierfür sind die Nitrierung und die Sulfonierung. Mit Halogenen dagegen ist die Addition an die Vinylgruppe deutlich schneller als die Substitutionsreaktion am Aromaten. Auch Sauerstoff oder Peroxycarbonsäuren greifen an der Vinylgruppe an und epoxidieren das Styrol zu Styroloxid.
Die Polymerisationseigenschaften des Styrols sind außergewöhnlich: Es geht thermische, radikalische, koordinative, anionische sowie kationische Polymerisationen ein. So kann zum Beispiel für eine kationische Polymerisation dem Styrol Eisenchlorid zugegeben werden. Wenn das Styrol nun mithilfe eines Bunsenbrenners zum Sieden gebracht wird, kann es aus der Flamme genommen werden und es reagiert von alleine zu Polystyrol weiter. Bei der thermischen Polymerisation wird Styrol einfach der Hitze ausgesetzt. Bei der radikalischen Polymerisation verbindet sich ein Radikal mit dem Styrol, dadurch wird das Styrol selbst zum Radikal, diese Radikale können nun polymerisieren, als Radikalstarter werden häufig organische Peroxide wie das Dibenzoylperoxid verwendet, am Ende verbinden sich wieder zwei Radikale (Kettenabbruch).
Verwendung
 Inzwischen stillgelegte Anlage der BASF zur Styrolherstellung auf einer Berliner Dauermarke aus der Briefmarkenreihe Industrie und Technik vom 15. Oktober 1975
Inzwischen stillgelegte Anlage der BASF zur Styrolherstellung auf einer Berliner Dauermarke aus der Briefmarkenreihe Industrie und Technik vom 15. Oktober 1975
Styrol wird zu vielen Kunststoffen weiterverarbeitet. Der wichtigste hiervon ist das Polystyrol. 1997 wurden 0,66 Millionen Tonnen Polystyrol aus Styrol hergestellt, somit wurden über 60 % des Styrols zu Polystyrol verarbeitet, Polystyrol ist damit einer der wichtigsten Kunststoffe überhaupt. Copolymere des Styrols (Polymer aus mehreren Monomeren) sind zum Beispiel das Acrylnitril-Butadien-Styrol (ABS), das Styrol-Acrylnitril (SAN), das Styrol-Butadien (SB) und das Acrylnitril-Styrol-Acrylester (ASA). Styrol wird in geringen, unbedenklichen Mengen als Zusatzstoff für Parfüms benutzt und auch in Gummi und Medikamenten eingesetzt. Es ist außerdem ein Lösemittel und wird zum Beispiel zur Herstellung von Polyesterharzen benötigt. Styrol ist zudem ein wichtiges Zwischenprodukt in der chemischen Industrie.
Gefahren
Styrol ist entzündlich, der Flammpunkt liegt mit ca. 31 °C niedrig. Es wird über die Atmungsorgane, weniger über die Haut, aufgenommen und lagert sich hauptsächlich in Leber, Niere, Gehirn und im Fettgewebe ab. Es reizt die Atemwege, Haut, Augen und Schleimhäute. Bei Inhalation und Verschlucken kann es zu unspezifischen Symptomen wie Konzentrationsschwäche, Müdigkeit, Übelkeit, Schwindel, Kopfschmerzen und Erregungszuständen kommen. Styrol kann fruchtschädigend wirken, wenn es in größeren Mengen eingenommen wird. Der MAK-Wert wurde 1987 von 100 ml/m3 auf 20 ml/m3 heruntergesetzt. Styrol steht im Verdacht krebserzeugend zu sein, hierzu liegen allerdings noch keine abschließenden Studien vor. Das beim Metabolismus entstehende Styroloxid stellte sich aber in Tierversuchen als eindeutig krebserzeugend heraus. Styrol zählt zu den Lösungsmitteln, die ototoxisch, das heißt gehörschädigend wirken. Styrol ist wassergefährdend (WGK 2), jedoch ist es biologisch über lange Zeit gesehen abbaubar. Styrol kann bei seinem Abbau mit sich selbst in Reaktion treten und sogar Explosionen verursachen. Mit einem Luftvolumenanteil von 0,9 bis 6,8 % bildet es ein explosionsfähiges Gemisch.
Metabolismus
Im Körper wird es fast vollständig zu dem Epoxid Styroloxid oxidiert und danach zu Phenylethylenglykol, Mandelsäure, Phenylglyoxylsäure, Benzoesäure und Hippursäure abgebaut. Styrol wird nach etwa einem halben Tag über den Harn ausgeschieden.
Einzelnachweise
- ↑ a b c d e f g h Eintrag zu CAS-Nr. 100-42-5 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 13. Januar 2008 (JavaScript erforderlich).
- ↑ a b c d Thieme Chemistry (Hrsg.): RÖMPP Online – Version 3.5. Georg Thieme Verlag KG, Stuttgart 2009.
- ↑ a b Eintrag zu CAS-Nr. 100-42-5 im European chemical Substances Information System ESIS (ergänzender Eintrag)
Literatur
- Beratergremium für Umweltrelevante Altstoffe (BUA) der Gesellschaft Deutscher Chemiker (Hrsg.): Styrol (Ethenylbenzol). Wiley/VCH, Weinheim 1990, ISBN 3-527-28255-6 (Gesellschaft Deutscher Chemiker. BUA-Stoffbericht 48).
- Frank-Dieter Kuchta: Thermische und laserinduzierte radikalische Polymerisationen von Styrol bis zu hohen Drücken, Temperaturen und Umsätzen. Cuvillier, Göttingen 1996, ISBN 3-89588-468-5 (Zugleich: Göttingen, Univ., Diss., 1996).
- Peter Quicker: Dehydrierung von Ethylbenzol zu Styrol. Ein Beitrag zur Entwicklung eines Membranreaktorverfahrens. Mensch & Buch, Berlin 2000, ISBN 3-89820-177-5 (Forschungsberichte aus den Ingenieurwissenschaften 73), (Zugleich: Erlangen, Nürnberg, Univ., Diss., 2000).
- Petra Schneider: Photoinitiierte Polymerisation von Styrol in festem Paraffin. Shaker Verlag, Aachen 1996, ISBN 3-8265-1521-8 (Berichte aus der Chemie), (Zugleich: Berlin, Techn. Univ., Diss., 1996).
Weblinks
- Ausführlich zur Toxizität
- Styrol auch für Menschen krebserregend? Quelle: LifeGen.de
- Zu den Gefahren
- www.chemgapedia.de: Zur Herstellung des Styrols, Eigenschaften und Geschichte
- Brand und Explosion eines mit Styrol gefüllten Tanklasters

Dieser Artikel wurde am 20. August 2005 in dieser Version in die Liste der lesenswerten Artikel aufgenommen. Kategorien:- Gesundheitsschädlicher Stoff
- Wikipedia:Lesenswert
- Alkenylbenzol
- Sekundärer Pflanzenstoff
- Aromastoff
Wikimedia Foundation.