- IF7
-
Strukturformel 
Allgemeines Name Iodheptafluorid Andere Namen Iod(VII)-fluorid
Summenformel IF7 CAS-Nummer 16921-96-3 PubChem 85645 Kurzbeschreibung farbloses Gas Eigenschaften Molare Masse 259,89 g·mol−1 Aggregatzustand gasförmig
Dichte Schmelzpunkt Sicherheitshinweise Gefahrstoffkennzeichnung [4] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Iodheptafluorid, auch bekannt als Iod(VII)-fluorid, ist eine chemische Verbindung aus den Elementen Iod und Fluor im Verhältnis 1:7. Es gehört zu den Interhalogenverbindungen.
Inhaltsverzeichnis
Eigenschaften
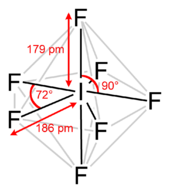
Iodheptafluorid ist ein stark fluorierendes Reagenz, das sogar mit Glas und Wasser reagiert und die Haut und die Schleimhäute reizt. Als Feststoff bildet es farblose Kristalle, die bei 4,5 °C sublimieren und bei knapp über Atmosphärendruck erhöhten Druck bei 5°C bis 6 °C schmelzen. Iodheptafluoridmoleküle haben eine pentagonal bipyramidiale Struktur, wie sie vom VSEPR-Modell vorhergesagt wird.
Herstellung
Iodheptafluorid kann aus den Elementen in zwei Schritten hergestellt werden. Zunächst verbrennt man Iod in Fluor zu Iodpentafluorid. Nach Erhöhung der Temperatur auf 300 °C und weiterer Fluorzufuhr kann das Reaktionsprodukt aufgefangen werden.[3]
Siehe auch
Quellen
- ↑ Jean D'Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker, dritte Auflage, Band 1, Seite 370/371
- ↑ W.C. Schumb und M.A. Lynch, Jr.: Iodine Heptafluoride. Preparation and some properties. Ind. and Eng. Chem. 42/7/1950. S. 1383–6. doi:10.1021/ie50487a035
- ↑ a b G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry. 2nd ed., vol. 1, Academic Press 1963, ISBN 012126601X S. 160–1
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
Wikimedia Foundation.