- VSEPR-Modell
-
Das EPA-Modell (Elektronenpaarabstoßungsmodell) oder VSEPR-Modell (VSEPR ist die Abkürzung für Valence shell electron pair repulsion, deutsch Valenzschalen-Elektronenpaar-Abstoßung) führt die räumliche Gestalt eines Moleküls auf die abstoßenden Kräfte zwischen den Elektronenpaaren der Valenzschale zurück.
Das Modell wurde von Ronald Gillespie und Ronald Nyholm entwickelt und wird deshalb auch Gillespie-Nyholm-Theorie genannt.
Inhaltsverzeichnis
Die abgeleiteten Regeln
Aus dem VSEPR-Modell ergeben sich für Moleküle des Typs AXn folgende Regeln[1]:
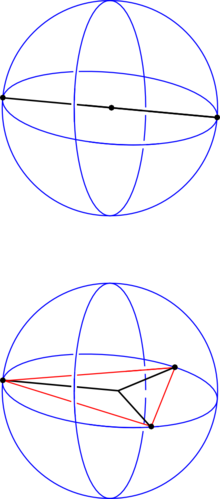
- Die Elektronenpaare des Zentralatoms (A) ordnen sich so an, dass der Abstand zwischen ihnen möglichst groß wird.
- Die freien Elektronenpaare (hier mit E symbolisiert) in einem Molekül vom Typ AXnEm beanspruchen mehr Raum als die bindenden Elektronenpaare und führen somit zu einer Vergrößerung der Winkel X-A-E und einer Verkleinerung der Winkel X-A-X.
- Größere Elektronegativitätsdifferenzen zwischen A und L vermindern damit den Raumbedarf der entsprechenden Bindung.
- Mehrfachbindungen beanspruchen mehr Raum als Einfachbindungen. Hierbei steigt der Platzbedarf mit der Bindungsordnung. Einzelne freie Elektronen in Radikalen nehmen hingegen weniger Raum ein als freie Elektronenpaare. Für die Bestimmung der groben Molekülstruktur werden jedoch nur die Sigma-Bindungen herangezogen. Das heißt, dass Mehrfachbindungen bei der Bestimmung der Struktur wie Einfachbindungen behandelt werden.
- Kleinere Zentralatome, bzw. größere negativ polarisierte Liganden, bewirken eine starke sterische und elektronische Abstoßungskraft, die die eines freien Elektronenpaars übertreffen kann.
Vorhersagen nach VSEPR bei freien Elektronenpaaren am Zentralatom
Molekülstrukturen können recht einfach durch Abzählen der "Reste" vorhergesagt werden, wenn keine freien Elektronenpaare am Zentralatom vorhanden sind. Dennoch lässt sich auch die näherungsweise Betrachtung von Verbindungen mit einem oder mehreren freien Elektronenpaaren schematisieren, indem freie Elektronenpaare wie Bindungspartner behandelt werden: Man gelangt hierüber zur Pseudostruktur des jeweiligen Moleküls.
Das Sauerstoffatom des Wassermoleküls, an welches zwei Wasserstoffatome kovalent geknüpft sind, weist zwei freie Elektronenpaare auf. Dementsprechend ergibt sich aus X = 2 (H-Atome) und E = 2 (freie e-Paare) 2+2=4 und somit eine tetraedrische Geometrie. Die Molekülgestalt selbst wird aber nur durch die Atomkerne beschrieben. Indem die freien Elektronenpaare nun „weggedacht“ werden, bleibt die Realstruktur zurück: gewinkelt.
# Molekültypen * Beispiel Pseudostruktur ** Realstruktur *** Winkel 1 
AX1H2 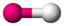
linear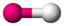
linear180° 2 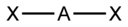
AX2BeCl2
CO2
linear
linear180° 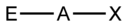
AX1E1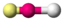
linear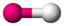
linear180° 3 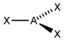
AX3BF3
NO3−
CO32−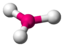
trigonal planar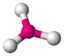
trigonal planar120° 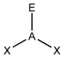
AX2ESO2
O3
NO2−
trigonal planar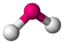
gewinkeltca. 115° 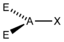
AX1E2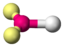
trigonal planar
linear180° 4 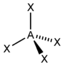
AX4CH4
SO42− PO43−
ClO4−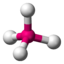
tetraedrisch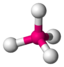
tetraedrisch109,5° 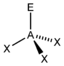
AX3ENH3
PCl3
tetraedrisch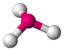
trigonal-pyramidalca. 107° 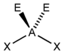
AX2E2H2O 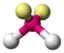
tetraedrisch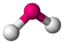
gewinkeltca. 104° 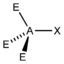
AX1E3HCl 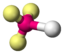
tetraedrisch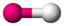
linear180° 5 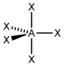
AX5PCl5 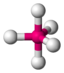
trigonal-bipyramidal
trigonal-bipyramidal120° / 90° 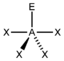
AX4ESF4 
trigonal-bipyramidal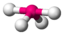
"Wippe", bisphenoidalca. 175° / 110° 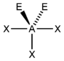
AX3E2ClF3 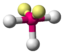
trigonal-bipyramidal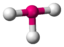
T-förmigca. 95° 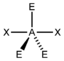
AX2E3XeF2 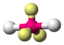
trigonal-bipyramidal
linear180° 6 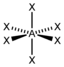
AX6SF6 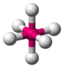
oktaedrisch (=quadratisch-bipyramidal,
trigonal-antiprismatisch)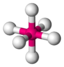
oktaedrisch (=quadratisch-bipyramidal,
trigonal-antiprismatisch)90° 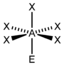
AX5EClF5 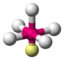
oktaedrisch (=quadratisch-bipyramidal,
trigonal-antiprismatisch)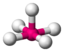
quadratisch-pyramidalca. 85° 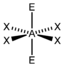
AX4E2XeF4 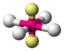
oktaedrisch (=quadratisch-bipyramidal,
trigonal-antiprismatisch)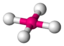
quadratisch-planar90° 7 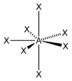
AX7IF7 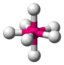
pentagonal-bipyramidal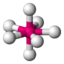
pentagonal-bipyramidal90° / 72° 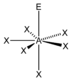
AX6EXeF6 
pentagonal-bipyramidal
pentagonal-pyramidalca. 90° / ca. 72° AX5E2 XeF5− pentagonal-bipyramidal pentagonal-planar 72° 8 AX8 IF8− tetragonal-antiprismatisch tetragonal-antiprismatisch 78° / 73° Anmerkungen:
* Keilstrichformel mit Zentralatom: A, Liganden: X und Elektronenpaar: E** nicht gebundene Elektronenpaare (blass gelb) als gedachte Bindungspartner*** reale räumliche Anordnung der AtomeGrenzen der Anwendbarkeit
Das VSEPR-Modell lässt sich auf Moleküle anwenden, bei denen die an das Zentralatom gebundenen Reste (Atome oder Atomgruppen) nicht allzu groß werden und keine spezifischen Wechselwirkungen aufeinander ausüben. Nicht oder nur eingeschränkt anwendbar ist sie auf Übergangsmetallverbindungen.
Nachweise
- ↑ Holleman-Wiberg, Lehrbuch der Anorganischen Chemie, 101.Aufl. 1995 deGruyter S. 136 und 315
Literatur
- Ronald J. Gillespie, Edward A. Robinson: Models of molecular geometry Chem. Soc. Rev., 2005, 34, S.396-407, doi:10.1039/b405359c
- R. J. Gillespie, I. Hargittai: The VSEPR Model of Molecular Geometry. 8 Aufl., Allyn & Bacon, Boston 1991, ISBN 978-0205123698.
Weblinks
 Wikibooks: Allgemeine und Anorganische Chemie/ Struktur von Molekülen – Lern- und Lehrmaterialien
Wikibooks: Allgemeine und Anorganische Chemie/ Struktur von Molekülen – Lern- und Lehrmaterialien
Wikimedia Foundation.