- Aluminiumcarbid
-
Kristallstruktur 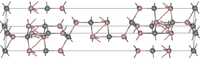
Allgemeines Name Aluminiumcarbid Verhältnisformel Al4C3 CAS-Nummer 1299-86-1 PubChem 16685054 Kurzbeschreibung farblose Kristalle[1]
Eigenschaften Molare Masse 143,96 g·mol-1 Aggregatzustand fest
Dichte 2,36 g·cm−3[2]
Schmelzpunkt Siedepunkt Zersetzung >2200 °C[2]
Löslichkeit in Wasser heftige Zersetzung[2]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [3] 

Gefahr
H- und P-Sätze H: 261-315-319-335 EUH: keine EUH-Sätze P: 231+232-261-305+351+338-422 [3] EU-Gefahrstoffkennzeichnung [2] 

Leicht-
entzündlichReizend (F) (Xi) R- und S-Sätze R: 11-15-36/37/38 S: 16-26-33-36/37/39 Thermodynamische Eigenschaften ΔHf0 −209 kJ·mol−1[4]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Aluminiumcarbid ist eine anorganische chemische Verbindung aus der Gruppe der Carbide; hier zählt es zu den Methaniden (C4−), da es formal vom Methan abgeleitet ist. Es besteht aus den Elementen Aluminium und Kohlenstoff.
Inhaltsverzeichnis
Synthese
Die Herstellung von Aluminiumcarbid erfolgt im elektrischen Ofen in Wasserstoffatmosphäre bei 2000 °C aus den Elementen. Durch Verunreinigung mit verbleibendem Aluminium das Reaktionsprodukt gelblich bis orange gefärbt.[5]
Eigenschaften
Es bildet farblose bis hellgelbe, hexagonale Kristalle (a = 3,325, c = 24,94 A) und schmilzt bei einer Temperatur von 2100 °C. Oberhalb von 2200 °C ist es nicht mehr stabil und zersetzt sich.[5]
Aufgrund seines Charakters als salzartiges Carbid reagiert Aluminiumcarbid mit Säuren zu Methan und Aluminiumsalzlösungen.
Aluminiumcarbid ist neben Berylliumcarbid das einzige Carbid, das mit Wasser unter Bildung von Methan reagiert.[1]
Einzelnachweise
- ↑ a b Helmut Sitzmann, in: Roempp Online - Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
- ↑ a b c d e Eintrag zu Aluminiumcarbid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23.12.2007 (JavaScript erforderlich).
- ↑ a b Datenblatt Aluminum carbide bei Sigma-Aldrich, abgerufen am 20. März 2011.
- ↑ PAETEC Formelsammlung Ausgabe 2003, Seite 116.
- ↑ a b Georg Brauer; Handbuch der präparativen anorganischen Chemie, Band 2, S.841; ISBN 3-432-87813-3.
Weblinks
- Omikron: Aluminiumcarbid
Kategorien:- Feuergefährlicher Stoff
- Reizender Stoff
- Aluminiumverbindung
- Carbid
Wikimedia Foundation.



