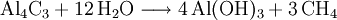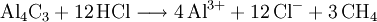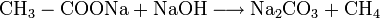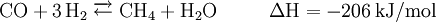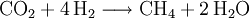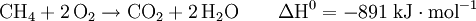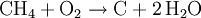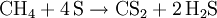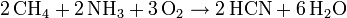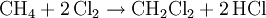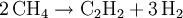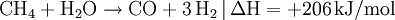- Methylwasserstoff
-
Strukturformel 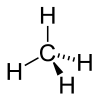
Allgemeines Name Methan Andere Namen Methylwasserstoff
Summenformel CH4 CAS-Nummer 74-82-8 PubChem 297 Kurzbeschreibung farbloses Gas Eigenschaften Molare Masse 16,04 g·mol−1 Aggregatzustand gasförmig
Dichte 0,72 g·l−1 (gasförmig, 0 °C, 1013 hPa)[1]
0,42 g·cm−3 (flüssig, am Siedepunkt)[1]Schmelzpunkt Siedepunkt −162 °C[1]
Dampfdruck 1470 hPa bei 115,6 K
Löslichkeit praktisch unlöslich in Wasser (26 ml·l−1)[1], in Ethanol und Diethylether gut löslich [2]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 
Hoch-
entzündlich(F+) R- und S-Sätze R: 12 S: (2)-9-16-33 WGK nicht wassergefährdend[1] GWP 25 (bezogen auf 100 Jahre) [4] Thermodynamische Eigenschaften ΔHf0 −74,87 kJ·mol−1 [5]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Methan ist ein farbloses und geruchloses Gas. Es ist das einfachste Alkan und der einfachste Kohlenwasserstoff überhaupt, die Summenformel lautet CH4, die C–H-Bindungen weisen in die Ecken eines Tetraeders. Methan ist der Hauptbestandteil von Erdgas, Biogas, Sumpfgas und ein wichtiger Bestandteil von Holzgas. Nach Kohlenstoffdioxid ist es das bedeutendste von Menschen freigesetzte Treibhausgas, wobei es 20- bis 30-mal wirkungsvoller ist, allerdings in kleineren Mengen in der Atmosphäre vorkommt. Dort reagiert es mit Sauerstoff zu Kohlenstoffdioxid und Wasser. Dieser Prozess ist allerdings langsam, die Halbwertszeit wird auf 14 Jahre geschätzt. Methan wird als Heizgas verwendet und dient als Ausgangspunkt für viele andere organische Verbindungen. Methan wird bei biologischen und geologischen Prozessen ständig neu gebildet und freigesetzt.
Inhaltsverzeichnis
Historische Informationen
Das Wort Methan stammt wohl aus dem griechischen „Μεθάνιον αέριον“ (Methanion Aerion) und zeigt, dass auch die Griechen schon von dem entzündlichen Gas wussten. So gab es in Kleinasien Orte, an denen sich Methangas-Quellen entzündeten. Ein Vulkangebiet, in dem solche Gase vorkamen, bekam nach diesem Gas auch den Namen Methana.
Methan war bereits den Alchemisten im Mittelalter als Fäulnisgas unter der Bezeichnung Sumpfluft bekannt.
Methan wurde 1667 von Thomas Shirley entdeckt. 1772 entdeckte Joseph Priestley, dass Methan bei Fäulnisprozessen entsteht. 1856 stellte Marcellin Berthelot Methan zum ersten Mal aus Kohlenstoffdisulfid und Schwefelwasserstoff her.
In älteren Texten wurde es gelegentlich auch als Methylwasserstoff bezeichnet.
Eigenschaften
Physikalische Eigenschaften
Methan ist ein farb- und geruchloses Gas, dessen Dichte kleiner ist als die von Luft, es steigt also in die höheren Schichten der Atmosphäre auf. Methan schmilzt bei −182,6 °C und siedet bei −161,7 °C. Aufgrund der unpolaren Eigenschaften ist es in Wasser kaum löslich, in Ethanol und Diethylether löst es sich jedoch gut. Schmelzwärme und Verdampfungswärme sind mit 1,1 kJ/mol und 8,17 kJ/mol für ein Gas relativ hoch, im Vergleich zu Metallen sind dies aber sehr geringe Werte. Der Heizwert Hi liegt bei 35,89 MJ·m−3. Die Standardentropie beträgt 188 J/mol·K, die Wärmekapazität 35,69 J/mol·K. Bei 90,67 K und 0,117 bar weist Methan einen Tripelpunkt auf, bei 190,56 K und 45,96 bar einen kritischen Punkt.
Die UN-Nummern von verdichtetem und tiefgekühlten Methan sind 1971 bzw. 1972.
Chemische Eigenschaften
Methan ist brennbar und verbrennt an der Luft mit bläulicher, nicht rußender Flamme. Es kann explosionsartig mit Sauerstoff, Luft und Chlor reagieren. Bei der Chlorierung entstehen Methylchlorid, Dichlormethan, Chloroform und Tetrachlormethan. Bei der Oxidation dagegen wird das Molekül komplett auseinandergerissen. Aus der Reaktion eines Methanmoleküls mit zwei Sauerstoffmolekülen entstehen zwei Wasser- und ein Kohlenstoffdioxidmolekül. Vom Methan leiten sich Methylverbindungen wie z. B. Methanol und die Methylhalogenide sowie die längerkettigen Alkane ab.
Vorkommen und Entstehung
Methananteil in Planeten-Atmosphären Planet Anteil Erde 1,75 ppm Mars 10,5 ppb Jupiter 3000 ± 1000 ppm Saturn 4500 ± 2000 ppm Neptun 1,5 % ± 0,5 % Methan kommt vielfältig vor und wird auf der Erde ständig neu gebildet, auch auf vielen anderen Planeten gibt es Methanvorkommen. Auf Meeresböden gibt es festes Methanhydrat, auch als „Methaneis“ bezeichnet. Die weltweiten Methanhydratvorkommen werden auf 500–3000 Gt C geschätzt.[6][7] Zum Vergleich: Die nachgewiesenen Kohlereserven betragen ca. 900 Gt C.[8] Eine Gewinnung des Methanhydrats könnte zur Lösung des Energieproblemes beitragen, ist jedoch problematisch; ein besonderes Problem besteht zum Beispiel darin, dass bei der Bergung viel Methan in die Atmosphäre gelangen würde und dort als starkes Treibhausgas zu einer weiteren Erwärmung und damit weiterer Freisetzung von Methan beitragen würde. Außerdem ist die Förderung von Methanhydrat (austretendes Methan am Meeresgrund wird durch den hohen Druck und die tiefe Temperatur zu Methanhydrat umgewandelt) nicht ungefährlich. Erste Förderungsversuche sind bereits im Gange. Die Folgen eines Raubbaus sind weitgehend ungeklärt – Forscher befürchten das Abrutschen der Kontinentalabhänge, welche zu großen Teilen aus Methaneis (welches durch die Förderung instabil werden könne) bestehen. Wegen der Klimaerwärmung bzw. der Meerwassererwärmung befürchten einige Forscher das Schmelzen und Verdampfen des Methanhydrat. Dies würde zusätzlich Methan als Treibhausgas in die Atmosphäre bringen und den anthropogenen Treibhauseffekt noch zusätzlich verstärken.
Methan ist Hauptbestandteil des Erdgases (85–98%). Auch das in Steinkohlelagern eingeschlossene Grubengas enthält hauptsächlich Methan.
Weltweit werden schätzungsweise jährlich 500 Millionen Tonnen Methan emittiert, etwa 70 % davon sind auf Aktivitäten der Menschen zurückzuführen. Durch landwirtschaftlichen Anbau und Tierhaltung wird Methan emittiert, 39 % dieser Emissionen gehen auf die Rinderhaltung zurück, 17 % auf den Nassreisanbau. In Deutschland wurden 1994 etwa 833.000 Tonnen Methan emittiert. Die Konzentration in der Atmosphäre hat sich von 1750 zu 2000 von 0,8 auf 1,75 ppm erhöht.
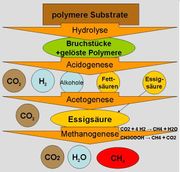
Beim Faulen organischer Stoffe unter Luftabschluss in Sümpfen oder am Grund stark verschmutzter Gewässer bildet sich Sumpfgas, ein Gemisch aus Methan und Kohlenstoffdioxid. Biogas besteht überwiegend aus Methan (etwa 60 %) und Kohlenstoffdioxid (etwa 35 %), daneben enthält es noch Wasserstoff, Stickstoff und Schwefelwasserstoff. Diese Umsetzungen organischen Materials sind mikrobiell (durch Mikroorganismen bewirkt) und laufen in mehreren Stufen ab, an denen verschiedene Gruppen von Mikroorganismen mit ihrem Stoffwechsel beteiligt sind. In der letzten Stufe entsteht Methan durch spezielle Vertreter der Archaeen, den Methanbildnern. Die sehr komplexen Umsetzungen organischen Materials unter Methanbildung können am Beispiel der Umsetzung von Glucose durch folgende Reaktionssummengleichung beschrieben werden:
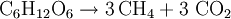
- Aus Traubenzucker wird Methan und Kohlenstoffdioxid.
Methan entsteht ebenfalls in tieferen Erdschichten bei hohen Temperaturen und Drücken. Diese Quellen setzen Methan meist bei vulkanischen Aktivitäten frei.
In der Atmosphäre des Mars wurde Methan nachgewiesen, allerdings nur etwa 10,5 ppb. Da es sich normalerweise nicht in der Atmosphäre halten kann und es keine Hinweise auf Meteoriten als Quelle gibt, muss es auf dem Mars neu gebildet worden sein, was ein Indiz für Leben sein kann. Allerdings könnte das Methan auch vulkanischen Ursprungs sein, es wurden aber bis jetzt keine Hinweise dafür gefunden. Auch in den Atmosphären von Titan, Jupiter, Saturn, Uranus, Neptun und Pluto gibt es Methanvorkommen. Außerhalb unseres Sonnensystems ist Methan als erstes organisches Molekül auf Planeten nachgewiesen worden.[9] Im Weltall ist Methan also in größeren Mengen auf Planeten, Kometen sowie Monden vorhanden.
Herstellung
Für die Herstellung aus Aluminiumcarbid gibt es zwei Methoden, sie werden allerdings meist nur im Labor eingesetzt. Die Synthese aus Kohlenstoffmonoxid hat eine besondere Wichtigkeit, da das giftige Kohlenstoffmonoxid, das eigentlich unerwünscht/unbrauchbar ist, sinnvoll genutzt werden kann, lediglich die Quelle des Wasserstoffs stellt bei dieser Synthese ein Problem dar.
- Aluminiumcarbid reagiert mit Wasser zu Aluminiumhydroxid und Methan, wenn es erhitzt wird.
- Aluminiumcarbid reagiert mit Salzsäure zu Aluminiumchlorid und Methan.
- Natriumacetat wird zusammen mit Natriumhydroxid erhitzt, es entsteht Natriumcarbonat und Methan.
- Kohlenstoffmonoxid reagiert mit Wasserstoff zu Methan und Wasser.
- Kohlenstoffdioxid reagiert mit Wasserstoff zu Methan und Wasser.
Diese Reaktion wurde im 19. Jahrhundert vom Franzosen und Nobelpreisträger Paul Sabatier entdeckt und wird deshalb Sabatier-Prozess genannt.
Heute wird auch viel Methan als Brennstoff in Biogasanlagen hergestellt. Auch durch Holzvergasung kann Methan gewonnen werden.
Umgang, Gefahren und Sicherheit
Mit einem Volumenanteil zwischen 4,4 und 16,5 Prozent in der Luft bildet es explosive Gemische. Durch unbemerktes Ausströmen von Erdgas kommt es immer wieder zu folgeschweren Gasexplosionen. Auch die gefürchteten Grubengasexplosionen in Kohlebergwerken (Schlagwetter) sind auf Methan-Luft-Gemische zurückzuführen. Methan ist hochentzündlich, der Flammpunkt liegt bei −188 °C, die Zündtemperatur bei 600 °C. Methanbehälter sollen an gut belüfteten Orten aufbewahrt werden, es sollte von Zündquellen ferngehalten werden und es sollten Maßnahmen gegen elektrostatische Aufladung getroffen werden. Methan wird unter hohen Drücken und meist bei tiefen Temperaturen (um die Dichte zu erhöhen) aufbewahrt, in Gasflaschen bei 150 bar, in Tankerschiffen bei etwa −160 °C.
Methan wird bei tiefen Temperaturen flüssig gelagert, weil die Dichte dadurch enorm erhöht werden kann. Aus diesem Grund kann es beim Austritt dieses gekühlten Methans leicht zu Erfrierungen kommen. Methan ist ungiftig, die Aufnahme von Methan kann allerdings zu erhöhten Atem- (Hyperventilation) und Herzfrequenzen führen, es kann kurzzeitig zu niedrigem Blutdruck, Taubheit in den Extremitäten, Schläfrigkeit, mentaler Verwirrung und Gedächtnisverlust, alles hervorgerufen durch Sauerstoffmangel, führen. Methan führt aber nicht zu bleibenden Schäden. Wenn die Symptome auftreten, sollte das betroffene Areal verlassen und tief eingeatmet werden, falls daraufhin die Symptome nicht verschwinden, sollte die betroffene Person in ein Krankenhaus gebracht werden.
Verwendung
Methan wird vorwiegend zur Wärmeerzeugung und zum Betrieb von Motoren durch Verbrennung genutzt. Neben Methan aus anderen Quellen wird zu diesem Zweck Biogas aus Mist, Gülle, Klärschlamm oder organischem Müll gewonnen. Früher wurde Methan durch Pyrolyse von Holz gewonnen (Holzvergasung). Holzgas diente im Zweiten Weltkrieg zum Betrieb von Automobilen.
Methan ist ein wichtiges Ausgangsprodukt für technische Synthesen von Wasserstoff, Methanol, Ethin, Blausäure, Schwefelkohlenstoff und Methylhalogeniden.
Reaktionen
Reaktionen mit Sauerstoff
Mit Sauerstoff geht Methan unterschiedliche Reaktionen ein, je nachdem wie viel Sauerstoff für die Reaktion zur Verfügung steht. Nur bei genügend großem Sauerstoffangebot ist eine vollständige Verbrennung des Methans mit optimaler Energieausbeute möglich.[10]
Bei ungenügender Sauerstoffzufuhr hingegen entstehen unerwünschte Nebenprodukte wie Kohlenstoffmonoxid (CO) und Kohlenstoff (Ruß). Ferner ist in diesem Fall die Nutzenergie geringer.
Weitere Reaktionen
Methan geht außer mit Sauerstoff noch vielfältige weitere Reaktionen ein. Viele davon sind sehr wichtig für die chemische Industrie, da die Entstehungsprodukte von großer technischer Bedeutung sind.
- Methan reagiert mit Schwefel bei 700 °C und unter Aluminiumoxidkatalysator zu Kohlenstoffdisulfid und Schwefelwasserstoff.
- Methan reagiert mit Ammoniak und Sauerstoff an einem Platinkatalysator zu Blausäure und Wasser.
- Methan reagiert mit Halogenen zu Methylhalogeniden und Halogenwasserstoffen, hier zum Beispiel mit Chlor.
- Methan reagiert bei 1400 °C und Wasserdampf zu Ethin und Wasserstoff.
- Methan reagiert bei 800 °C am Nickelkontakt mit Wasser zu Kohlenstoffmonoxid und Wasserstoff.
Biologie, Geologie und Klimatologie
Methan ist ein wichtiges Treibhausgas. Das Erwärmungspotenzial von 1 kg Methan ist, auf einen Zeitraum von 100 Jahren betrachtet, 25 mal höher als das von 1 kg Kohlenstoffdioxid.[4] Die zunehmende Haltung von Rindern, der häufige Nassreisanbau und Emissionen von Deponiegas führen zu einer Verstärkung des Treibhauseffektes.
Die archaellen Methanbildner sind für die ständige Neubildung von Methan hauptverantwortlich. Ein Hausrind stößt täglich etwa 150–250 l Methan aus, weil im Rindermagen archaeelle Methanbildner an der Zersetzung von Zellulose beteiligt sind. Neue Erkenntnisse zeigen, dass Pflanzen ständig Methan produzieren und so schon immer zum Methan-Gehalt der Atmosphäre beitragen.[11]
Methan war neben Ammoniak und Wasserdampf ein wichtiger Bestandteil der Uratmosphäre. Hierbei soll es nach Stanley Miller eine wichtige Rolle bei der Entstehung der Erdatmosphäre gespielt haben. In einem Versuch setzte er diese Gase eine Woche lang elektrischen Entladungen aus, wobei zahlreiche organische Verbindungen, unter anderem Aminosäuren, entstanden.
In einer sauerstoffhaltigen Atmosphäre wird Methan langsam, insbesondere durch Hydroxyl-Radikale, oxidiert. Ein einmal in die Atmosphäre gelangtes Methan-Molekül hat dort eine durchschnittliche Verweilzeit von zwölf Jahren.
Methan außerhalb der Erde
Auf dem Saturnmond Titan herrscht bei −180 °C und ca. 1,6 Bar Atmosphärendruck fast der Tripelpunkt des Methans. Methan kann deshalb auf diesem Mond in allen drei Aggregatzuständen auftreten. Es gibt Wolken aus Methan, aus denen Methan regnet, das dann durch Flüsse in Methanseen fließt, dort wieder verdunstet und so einen geschlossenen Methankreislauf bildet (analog zum Wasserkreislauf auf der Erde).
Für den Ontario Lacus, einen See nahe dem Südpol des Titan, wurde jedoch als Hauptbestandteil das schwerere Ethan nachgewiesen.
- Siehe auch: Liste von Methanseen auf dem Titan
Im März 2008 wurde Methangas erstmals auch auf einem Planeten außerhalb unseres Sonnensystems gefunden (Exoplanet HD 189733b vom Typ der hot Jupiters).
2009 wurde über Methaneruptionen auf dem Mars berichtet (Michael J. Mumma et al.: Strong Release of Methane on Mars in Northern Summer 2003, Science January 15, 2009).
Quellen
- ↑ a b c d e f Eintrag zu CAS-Nr. 74-82-8 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 13. Januar 2008 (JavaScript erforderlich)
- ↑ S. Budavari et al. (1996): The Merck Index – Twelfth Edition, MERCK & CO., INC., S. 1018
- ↑ Eintrag zu CAS-Nr. 74-82-8 im European chemical Substances Information System ESIS
- ↑ a b P. Forster, P., V. Ramaswamy et al.: Changes in Atmospheric Constituents and in Radiative Forcing. In: Climate Change 2007: The Physical Science Basis. Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge University Press, Cambridge und New York 2007, S. 212, (PDF)
- ↑ Chase, M.W. Jr. (1998): NIST-JANAF Thermochemical Tables, Fourth Edition, J. Phys. Chem. Ref. Data, Monograph 9, 1-1951
- ↑ B. Buffet, D. Archer (2004): Global inventory of methane clathrate: sensitivity to changes in the deep ocean, in: Earth and Planetary Science Leters, Vol 227, S. 185–199, (PDF)
- ↑ A. V. Milkov (2004): Global estimates of hydrate-bound gas in marine sediments: how much is really out there?, in: Earth-Science Reviews, Vol. 66, S. 183–197
- ↑ BP (2006): Quantifying energy – BP Statistical Review of World Energy, Juni 2006, [1]
- ↑ jpl.nasa.gov: Astronomers Detect First Organic Molecule on an Exoplanet (englisch, 19. März 2008), abgerufen am 20. März 2008
- ↑ Standardreaktionsenthalpie für die Verbrennung von Methan und diversen Erdölprodukten vgl. S. 3 ff. in: Herbert Mayr: Vorlesung 9: Erdölverarbeitung, LMU München: Physikalisch-organische Chemie, 2006 (PDF-Datei; ca. 190 kB)
- ↑ Ute Kehse (2006): Pflanzen mit schlechtem Atem, online
Literatur
Bücher
- Peter Pfeifer, Roland Reichelt (Hrsg.): H2O & Co Organische Chemie. Oldenbourg, München 2003, ISBN 3-486-16032-X (Extrakapitel über Methan und Informationen auch zu den anderen Alkanen)
- Christian Felske: Minimierung von Restgasemissionen aus Siedlungsabfalldeponien durch Methanoxidation in Deponieabdeckschichten, ISBN 3-8322-2168-9
- Christiane Werth: Zur Methanaktivierung in Salzschmelzen, ISBN 3-8322-2597-8
Zeitschriftenartikel
- o.A.: Pflanzen – eine vergessene Methanquelle. in: Bergbau Heft 1/2007, S. 7–8 (Digitalisat, pdf, 72.2 kB)
Siehe auch
Weblinks
Wikimedia Foundation.