- Isotopenanalyse
-
Isotopenuntersuchungen stellen den Anteil von Isotopen eines chemischen Elementes innerhalb einer Probe fest. Die meisten chemischen Elemente bestehen aus mehreren verschieden schweren Isotopen. Mit einem modernen Massenspektrometer kann man diese isotopische Zusammensetzung (die Isotopie) sehr genau bestimmen (bis Nanogramm Probenmenge und je nach Element und Isotop bis ppt Genauigkeit).
Die Isotopenuntersuchung erfolgt durch unterschiedliche Arten von Massenspektrometrie und Beschleuniger-Massenspektrometrie. Um aus dem Stromfluss bzw. der Zählrate an den Detektoren die Konzentration des betreffenden Isotops zu ermitteln, ist ein sogenannter Spike erforderlich. Spikes sind Substanzen mit sehr genau bekannter (isotopischer) Zusammensetzung, die als Referenz gleichzeitig mit der Probe gemessen werden.
Beispiele für Isotopenuntersuchungen:
- Die Messung radiogener Isotope liefert Rückschlüsse auf das Alter eines Minerals. Siehe Geochronologie, Radiometrische Datierung
- Isotope leichterer Elemente (vor allem Kohlenstoff, Sauerstoff, Stickstoff, Schwefel, Wasserstoff), dienen als Anzeiger für regionale und klimatische Herkunft von Lebensmitteln, etwa von Obstsäften, oder auch für die Umweltbedingungen, die bei der Bildung etwa von Muschel- oder Foraminiferen-Schalen im Ozean geherrscht haben.
Inhaltsverzeichnis
Terminologie
Die Ergebnisse einer Isotopenmessung werden üblicherweise als relativer Unterschied zu einem festen Standard in Promill angegeben. Zum Beispiel ist
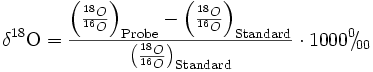 .
.Wasserstoff-System
Wasserstoff (H) besitzt zwei stabile Isotope, die ausnahmsweise Namen tragen: Protium oder Protonen (1H) und Deuterium (2H oder D).
Tritium (3H oder T) ist radioaktiv mit einer Halbwertszeit von 12,3 Jahren, auf der Erde gibt es nur wenige Kilogramm Tritium als natürliches Vorkommen. Es entsteht durch die Wirkung kosmischer Strahlung in den oberen Schichten der Atmosphäre.
Deuterium wird auch als schwerer und Tritium als überschwerer Wasserstoff bezeichnet.
Anwendungen
Regenwasser enthält Tritium, das durch die kosmische Strahlung in der Atmosphäre entstanden ist. Da das Tritium mit der Zeit zerfällt, kann man z.B. das Alter von Quellwasser bestimmen. Siehe auch Tritiummethode.
Da Tritium in der Natur so selten ist, lassen sich kleinste Kontaminationen aus technischen Anwendungen leicht feststellen. Mehr zu technischen Anwendungen, siehe Tritium.
Sauerstoff-System
Der Sauerstoff hat 3 stabile Isotope: 16O, 17O und 18O.
Das Isotopenverhältnis 18O/16O im Wasserdampf in der Atmosphäre sowie im Wasser aller Gewässer ist regional unterschiedlich. Beim Verdunsten von Wasser tritt ebenso wie bei der Kondensation eine Isotopenfraktionierung auf. Beim Verdampfen geht das leichtere Isotop bevorzugt in den Dampf über, bei der Kondensation (z.B. Wolkenbildung und Regen) geht bevorzugt das schwerere Isotop in die flüssige Phase.
Als Standard für die Berechnung des δ18O Wertes (Siehe Terminologie) wird das Isotopenverhältnis des "Standard Mean Ocean Water" (SMOW) verwendet.
Kohlenstoff-System
Hauptartikel: Radiokarbondatierung
Kohlenstoff(C) hat zwei stabile, natürlich vorkommende Isotope: 12C (98,98%), 13C (1,11%) und das instabile Isotop 14C (0,000 000 000 1%). Die wichtigste Anwendung ist die Radiokarbondatierung bei dem der 14C-Gehalt zur Bestimmung des Entstehungsdatums organischer, sowie anorganischer Proben gemessen wird.
Der δ13C-Wert von C3-Pflanzen (ca. -28‰) ist niedriger als der Wert von C4-Pflanzen (ca. -14‰). Zudem haben zum Beispiel Wasserpflanzen und Fische einen noch höheren Wert. Das ermöglicht es Anthropologen anhand des δ13C-Werts von z.B. menschlichen Knochen, Rückschlüsse auf die Ernährung zu ziehen. Dies ist besonders in Verbindung mit dem δ15N interessant.
Kalium-Argon-System
Hauptartikel: Kalium-Argon-Datierung
Die Argonmethode macht sich zu Nutze, dass das gewöhnlich feste Element Kalium 40K mit einer Halbwertszeit von 1,3 Milliarden Jahren zum gasförmigen 40Ar zerfällt, welches aus einer Schmelze, nicht aber aus einem Festkörper entweichen kann. In der Archäometrie und in der Geologie wird damit die Erstarrungszeit vulkanischer Materialien datiert.
Rubidium-Strontium-System
Hauptartikel Strontiumisotopenanalyse
Strontium hat vier stabile, natürlich vorkommende Isotope: 84Sr (0,56 %), 86Sr (9,86 %), 87Sr (7,0 %) und 88Sr (82,58 %).
87Sr ist ein Zerfallsprodult von 87Rubidium, das eine Halbwertszeit von 48,8 Milliarden Jahren hat. Daher kann man das Alter mancher Gesteine mit Hilfe ihrer Rubidium- und Strontiumisotopenverhältnisse bestimmen.
Bei Lebewesen (z. B. Menschen) wird Strontium an Stelle von Calcium auch in Knochen und Zahnschmelz eingebaut. Anders als in den Knochen wird das Sr im Zahnschmelz nach dem vierten Lebensjahr nicht mehr ausgetauscht. Deshalb bleibt dort das Isotopenverhältnis identisch mit dem am Lebensort des Kindes. Die Strontiumisotopenanalyse nutzt man für archäologische Untersuchungen von Skelettfunden. Vergleicht man das Sr-Isotopenverhältnis in den Knochen mit dem in den Kauzähnen, belegt ein unterschiedliches Verhältnis eine nach dem vierten Lebensjahr erfolgte Wanderbewegung.
Thorium-Uran-Blei-Methode
Hauptartikel Uran-Thorium-Datierung, Uran-Blei-Datierung
Bei der Th-U-Pb Methode bestimmt man die Konzentrationen und die Isotopenverhältnisse der Elemente Thorium, Uran und Blei. Jedes der drei Isotope 238U, 235U und 232Th zerfällt radioaktiv über komplizierte Zerfallsreihen in genau ein Bleiisotop:
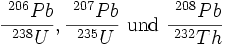
Da man die Isotopie von drei unabhängigen Zerfallsreihen bestimmt, ist theoretisch eine dreidimensionale Darstellung der Ergebnisse möglich. Meist weicht man jedoch auf eine zweidimensionale Darstellung aus und benutzt das 207Pb/232Th-System zur Fraktionierungskorrektur.
Anwendungen
- Datierung von Mineralen: Apatit (Zahnschmelz, siehe oben), Monazit oder Zirkon
- Die Herkunft von Kleidung, Menschen, Tieren, Lebensmitteln kann im weltweiten Maßstab zwischen verschiedenen Kontinenten unterschieden werden. Bei vorgegebener regionaler Eingrenzung, zum Beispiel Butter aus Deutschland sind, durch die Analyse des Wassers im Lebensmittel, auch feinere Unterscheidungen möglich.
- Durch die Untersuchung von Th-U-Pb Isotopen kann man beispielsweise auch zwischen verschiedenen Typen von Kernreaktoren oder Kernwaffen unterscheiden.
Weitere Methoden
- Stickstoff-System
- Schwefel-System
- Sm-Nd-System
- U-Pb-System
- U-He-Methode (historisch)
- Pb-Methode (historisch)
- Pb-Pb-Methode
- U-Pb Methode
Wikimedia Foundation.
