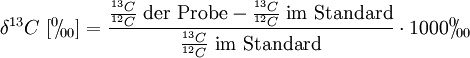- C4-Pflanzen
-
Zu den C4-Pflanzen werden Pflanzen gezählt, die im Vergleich zu den C3-Pflanzen eine schnellere Photosynthese bei mehr Wärme und Licht (aber u. U. kürzeren Tagen) durchführen und bei denen sich ein weiterer Weg zur Kohlenstoffdioxid-Fixierung entwickelt hat. Hintergrund dieser evolutionären Anpassung ist, dass Pflanzen bei hohen Umgebungstemperaturen ihre Stomata schließen müssen, um den Wasserverlust durch Transpiration in Grenzen zu halten. Durch das Verschließen der Stomata wird allerdings auch die Aufnahme von CO2 für die Photosynthese erschwert. C4 Pflanzen besitzen deshalb eine Möglichkeit, selbst geringste CO2 Konzentrationen für die Photosynthese zu nutzen. Das Enzym PEP-Carboxylase besitzt eine viel höhere Affinität für CO2 als das RuBisCo der C3-Pflanzen. Da das erste fassbare Fixierungsprodukt ein C4-Körper ist, das Oxalacetat, wurde diese Bezeichnung zur Unterscheidung von den Pflanzen mit „normalem“ Photosynthesestoffwechsel gewählt.
Inhaltsverzeichnis
Vorkommen der C4-Photosynthese im Pflanzenreich
Bekannte C4-Pflanzen sind Amarant, Hirse, Mais, Zuckerrohr und Chinaschilf. Die meisten gehören zu den Gräsern, gefolgt von Seggen. Doch auch bei einer Reihe von Zweikeimblättrigen gibt es diesen Stoffwechselweg, insbesondere bei den Fuchsschwanzgewächsen und anderen Nelkenartigen, bei Wolfsmilchgewächsen und vereinzelt bei Windengewächsen und Korbblütlern.
Entdeckung
Die ersten Untersuchungen an einer C4-Pflanze wurden durch Hugo Kortschak durchgeführt. Um 1950 identifizierte er an einem Zuckerrohr-Forschungsinstitut in Hawaii als erstes CO2-Fixierungsprodukt L-Malat und L-Aspartat. Diese sind C4-Verbindungen und standen damit in Widerspruch zu den Befunden von Melvin Calvin, Andrew Benson und James Bassham. Diese hatten gezeigt, dass das erste Stoffwechselprodukt bei der CO2-Fixierung in der Dunkelreaktion eine C3-Verbindung, 3-Phosphoglycerat, ist. Die Ergebnisse Kortschaks wurden aber erst zehn Jahre später veröffentlicht. Auch der Russe Yuri Karpilov entdeckte an Mais, dass das erste Fixierungsprodukt eine C4-Verbindung ist.
Erst die australischen Forscher Marshall Davidson Hatch und Charles Roger Slack konnten mit jenen Ergebnissen und eigenen Untersuchungen die Biochemie des Stoffwechselweges entschlüsseln. Die Funktion und Bedeutung wurde in den 1970er-Jahren veröffentlicht. Infolgedessen wird der C4-Stoffwechsel nach seinen Entdeckern auch als Hatch-Slack-Weg bzw. Hatch-Slack-Zyklus bezeichnet.
Biochemie
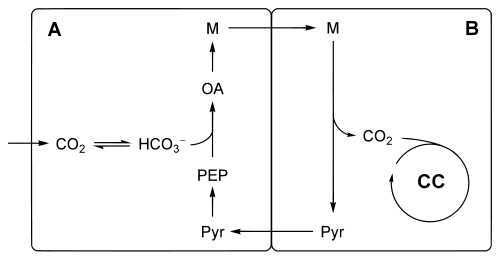
Die Reaktionen dieses C4-Stoffwechselweges erstrecken sich über zwei benachbarte Zelltypen, welche den C4-Pflanzen auch eine typische Anatomie verleihen. Hierbei wird CO2 zunächst in Mesophyllzellen (A, vgl. Abbildung) vorfixiert. Mesophyllzellen enthalten kein RubisCO. Das in Form von Malat gebundenen CO2 wird über Plasmodesmen in Bündelscheidenzellen (B, vgl. Abbildung) transportiert. Diese können aufgrund der Enzymausstattung von C3-Pflanzen den Calvin-Zyklus ausführen. Da die Bündelscheidenzellen von den Mesophyllzellen kranzförmig umgeben sind, spricht man auch von einer Kranzanatomie.
Dieser Vorgang stellt eine CO2-Pumpe dar, die mit der Fixierung von CO2 in Form von Bicarbonat (HCO3−) beginnt. Die Bildung von HCO3− aus CO2 wird durch eine Carboanhydrase katalysiert.
Eine Phosphoenolpyruvat-Carboxylase katalysiert die Kondensation eines Moleküls Phosphoenolpyruvat mit HCO3−, so dass Oxalacetat entsteht. Dieses wird in L-Malat, bei manchen C4-Pflanzen in L-Aspartat, umgesetzt. In dieser Form wird es durch die Plasmodesmen in die Bündelscheidenzellen transportiert.
Wie nun das Kohlenstoffdioxid wieder freigesetzt und in den Calvin-Zyklus eingespeist wird, ist bei C4-Plfanzen unterschiedlich.
- Ein Malat-Enzym katalysiert die Decarboxylierung von Malat zu Pyruvat. Hierbei wird entweder NADP+ bei einem NADP-Malat-Enzymtyp in den Chloroplasten reduziert. Oder dies erfolgt mit NAD+ bei einem NAD-Malat-Enzym in den Mitochondrien.
- Bei dem Phosphoenolpyruvat-Carboxykinasetyp wird im Cytosol Oxalacetat zu Phosphoenolpyruvat unter ATP-Verbrauch decarboxyliert.
Phosphoenolpyruvat (PEP) bzw. Pyruvat werden durch Plasmodesmen wieder zurück in die Mesophyllzelle transportiert. Bei Pflanzen mit dem NAD-Malat-Enzymtyp wird Pyruvat vorher zu L-Alanin umgewandelt und dieses transportiert. Pyruvat selbst wird durch eine Pyruvat-Phosphat-Dikinase in den Chloroplasten der Mesophyllzelle unter ATP-Verbrauch zu PEP umgesetzt und kann damit wieder mit Bicarbonat kondensieren.
Ökonomische und ökologische Aspekte
C4-Pflanzen sind den meisten C3-Pflanzen insofern überlegen, als sie CO2 und Wasser ökonomischer nutzen können: (WUE water-use-efficiency)
- Während C4-Pflanzen zur Bildung von 1 g Trockenmasse 230–250 ml Wasser benötigen, liegt der Bedarf für C3-Pflanzen zwei bis dreimal so hoch.
- Die optimale Wachstumstemperatur liegt zwischen 30 und 45 °C, für C3-Pflanzen dagegen bei 15–25 °C.
- C4-Pflanzen können zur Produktion von Biomasse für die Energiegewinnung genutzt werden. Chinaschilf erreicht Erträge von 15 bis 25 Tonnen Trockenmasse je Hektar und Jahr.[1]
- Wachsende Aufmerksamkeit gewinnen auch tropische C4-Futtergräser, die mit Stickstoff bindenden Bakterien vergesellschaftet sind und somit kaum einer Zusatzdüngung bedürfen.
- Obwohl zu den Gräsern gehörend, ist Reis keine C4-Pflanze. Um die Erträge zu steigern, gab man ihm die Genausstattung vom Mais und verzeichnete Ertragssteigerungen von bis zu 35 Prozent.
In den letzten dreißig Jahren ist eine Ausbreitung von C4-Pflanzen auch auf warmen, sonnigen Standorten in Mitteleuropa zu beobachten. Zumeist handelt es sich um hirseartige Gräser und Fuchsschwanzarten. Deren Ausbreitung wird zumindest bisher nicht als Gefahr für die heimische Flora gewertet.[2]
Isotopendiskriminierung
C4-Pflanzen lassen sich durch das Verhältnis der beiden Kohlenstoff-Isotope 12C und 13C erkennen. Die beiden Isotope kommen in der Atmosphäre mit 98,89 % und 1,11 % vor (das radioaktive Isotop 14C spielt in diesem Zusammenhang keine Rolle). Das Enzym RubisCO reagiert mit 12CO2 und diskriminiert gegen 13CO2, bei C4-Pflanzen ist daher das 13C/12C Verhältnis höher als in C3-Pflanzen. Es wird als δ-13C-Wert ausgedrückt:
Als Standard ist ein bestimmtes Kalkgestein definiert (Pee Dee Belemnite). Produkte der C3-Photosynthese besitzen δ-13C-Werte von rund −28 ‰.
Die PEP-Carboxylase präferiert 13CO2 weniger stark als RubisCO, in C4-Pflanzen wird jedoch fast das gesamte CO2 durch die PEP-Carboxylase vorfixiert. Durch die hohe interne CO2-Konzentration in den Bündelscheidenzellen kommt auch die Diskriminierung der RubisCO nicht zum Tragen. Daraus ergibt sich für C4-Pflanzen ein δ-13C-Wert von durchschnittlich −14 ‰. Durch Bestimmung des δ-13C-Wertes mittels Massenspektrometrie kann man daher unterscheiden, ob Zucker aus der Zuckerrübe (C3) oder aus Zuckerrohr (C4) stammt.
Einzelnachweise
- ↑ Produktionsaspekte Weiden und Miscanthus
- ↑ Brandes, Dietmar (1995) Breiten sich C4-Pflanzen in Mitteleuropa aus?
Literatur
- W. J. S. Downton: The occurrence of C4 photosynthesis among plants. In: Photosynthetica 9, 1975, S. 96-105
- Hans W. Heldt und Birgit Piechulla: Pflanzenbiochemie. Spektrum Akademischer Verlag GmbH, 4. Auflage 2008; ISBN 978-3-8274-1961-3; S. 211ff.
Weblinks
Wikimedia Foundation.