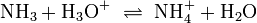- Ammoniumion
-
 Salmiaknebel beim Zusammentreffen von Ammoniak- und Salzsäuredämpfen
Salmiaknebel beim Zusammentreffen von Ammoniak- und Salzsäuredämpfen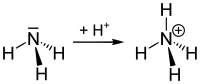 Bildung eines Ammonium-Ions durch Protonierung von Ammoniak.
Bildung eines Ammonium-Ions durch Protonierung von Ammoniak.Das Ammonium-Ion NH4+ ist ein Kation, das chemisch ähnlich reagiert wie Alkalimetall-Ionen und Salze entsprechender Formel bildet, beispielsweise Ammonsalpeter (Ammoniumnitrat) NH4NO3 oder den Salmiak (Ammoniumchlorid). Es ist die konjugierte Säure zur Base Ammoniak NH3.
Ammoniak/Ammonium-Gleichgewicht in saurer Lösung:
Es ist nicht mit quartären Ammoniumverbindungen zu verwechseln, bei denen Stickstoff ebenfalls vier Bindungspartner hat, diese jedoch alle organische Reste und keine Wasserstoffe sind.
Inhaltsverzeichnis
Ammonium in der Natur
In der Natur entsteht Ammonium in erster Linie beim Abbau von Proteinen. So wird es von Fischen und den meisten anderen Wasserorganismen als Endprodukt, z. B. über die Kiemen, ausgeschieden. Auch bei der bakteriellen Verrottung abgestorbener Biomasse wird es als Endprodukt freigesetzt.
Ammonium wird im Boden und in Gewässern unter Sauerstoffverbrauch bakteriell (Nitrosomonas) zuerst zu Nitrit und von einer anderen Bakterienart (Nitrobacter) weiter zu Nitrat oxidiert und damit „entgiftet“. Neben Bakterien spielen auch Archaea bei der Ammoniumoxidation im Boden eine wichtige Rolle.[1] Dieser Vorgang wird Nitrifikation genannt und ist im Boden durchaus erwünscht. Auch in Gewässern ist die Nitrifikation ein wichtiger Teil der Selbstreinigung.
Ammoniak ist für Fische schon in geringen Konzentrationen giftig. Ammoniumgehalte im Wasser von 0,5 bis 1 mg/l werden deshalb, je nach dem pH-Wert des Wassers, als bedenklich für Fische eingestuft. Bei Ammoniumgehalten über 1 mg/l ist ein Gewässer für Fischereizwecke nicht geeignet.
Ammonium im Körper
Das Ammoniumion ähnelt dem Kalium-Ion (K+) sowohl in Größe als auch Ladung und kann daher im Organismus dessen Stelle einnehmen. Da es aber anders reagiert, z. B. von Synapsen, die kaliumgesteuert sind, nicht wieder abgespalten werden kann, blockiert es diese dauerhaft. Es wirkt deshalb in allen Organismen mit kaliumgesteuerten Synapsen als Nervengift.
Ammonium im Urin weist auf Konkremente hin.
Ammonium in der Chemie
Ammonium bildet ein Dissoziationsgleichgewicht mit Ammoniak. Wegen der Beteiligung eines Oxonium-Ions ist dieses Gleichgewicht vom pH-Wert abhängig. Der Anteil des Ammoniaks steigt mit zunehmendem pH-Wert und steigender Temperatur.
Ammonium bildet bei der Elektrolyse mit einer Quecksilberkathode mit dem Quecksilber ein Ammoniumamalgam, das sich beim Erhitzen unter Bildung von Ammoniak zersetzt.
Zur Prüfung (Vorprobe) einer Substanz auf Ammonium versetzt man sie mit etwas Natronlauge oder Natriumhydroxid. Das dabei freigesetzte Ammoniak ist entweder zu riechen oder man weist es anhand der basischen Verfärbung eines feuchten pH-Teststreifens über dem Reaktionsgemisch (Kreuzprobe) nach.
Ein empfindlicher Nachweis ist die Reaktion mit Nesslers Reagenz, das allerdings auch auf Amine anspricht. Eine empfindliche und selektive quantitative Bestimmung erfolgt nach DIN meist mithilfe der Berthelot-Reaktion unter Bildung eines blauen Indophenols, dessen Konzentration colorimetrisch gemessen werden kann.
Der pKs-Wert von Ammonium beträgt 9,2.
Einzelnachweise
- ↑ Scinexx.de: Tiefsee-Methanfresser eingefangen, Meldung vom 15. Mai 2008
Weblinks
Wikimedia Foundation.