- Jodwasserstoffsäure
-
Allgemeines Name Iodwasserstoffsäure Andere Namen Jodwasserstoffsäure
Summenformel HI(aq) CAS-Nummer 10034-85-2 (für Iodwasserstoff) Kurzbeschreibung farblose, wässrige, saure Lösung von Iodwasserstoff Eigenschaften Molare Masse 127,91 g/mol Aggregatzustand wässrige Lösung
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [1] 
Ätzend (C) für Zubereitungen ≥ 10% HI [2]
R- und S-Sätze R: 35 S: (1/2)-9-26-36/37/39-45 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Iodwasserstoffsäure ist eine Lösung von Iodwasserstoff (HI) in Wasser. Ihre Salze heißen Iodide. Sie ist nach Flusssäure, Salzsäure und Bromwasserstoffsäure das letzte Glied in der Reihe der Halogenwasserstoffsäuren. Die Säurestärke nimmt innerhalb der Hauptgruppe zu. Allerdings ist Iodwasserstoffsäure nicht nur die stärkste Halogenwasserstoffsäure, sondern auch die stärkste bekannte sauerstofffreie Säure überhaupt (vgl.: Säurestärke).
Die wässrige Lösung von Iodwasserstoff (HI) reizt die Atemwege und verursacht schwere, schlecht heilende Verätzungen. Daher ist beim Umgang mit Iodwasserstoffsäure stets Vorsicht geboten. In den Handel kommt Iodwasserstoffsäure meist als 57 %ig Säure.
Synthese
Iodwasserstoffsäure kann prinzipiell auf folgenden Synthesewegen hergestellt werden:
Ein Syntheseweg erfolgt mittels Verdrängungsreaktion. Hierbei wird das Iodid mittels einer starken Säure (Phosphorsäure) aus ihrem Salz vertrieben (Kaliumiodid). Es entsteht Iodwasserstoff und ein Phosphorsalz des Kaliums, Kaliumdihydrogenphosphat.
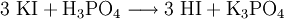
- Kaliumiodid und Phosphorsäure reagieren zu Iodwasserstoff und Kaliumphosphat.
Eine weitere Synthese ist durch Oxidation von Schwefelwasserstoff mit Iod möglich. Dabei flockt elementarer Schwefel aus, währende der Iodwasserstoff gelöst bleibt. Der Schwefel kann anschließend abfiltriert werden.[3]
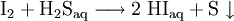
- Iod und Schwefelwasserstoff reagieren in wässriger Lösung zur Iodwasserstoffsäure und Schwefel, der in wässriger Lösung ausflockt.
Eine weitere Synthese von Iodwasserstoff erfolgt mittels eines Zweischritt-Prozesses: Zuerst wird Iod mit Phosphor in einer sauerstoffarmen Umgebung verbrannt. Anschließend wird das entstandene Phosphortriiodid langsam in Wasser gegeben.
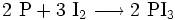
- Phosphor und Iod reagieren zu Phosphortriiodid.
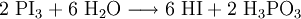
- Phosphortriiodid und Wasser reagieren stark exotherm unter der Bildung von Iodwasserstoffsäure und Phosphonsäure.
Nachweis
Der Nachweis der Iodidionen kann mit Silbernitrat-Lösung vorgenommen werden. Hierbei wird ein gelber, äußerst schwerlöslicher Niederschlag von Silberiodid beobachtet. Dieser ist um Zehnerpotenzen schwerer löslich als jener der anderen Silberhalogenide. Deshalb wird bei Zugabe von gesättigter Silberchlorid-Lösung zu einer iodidhaltigen Lösung ein Niederschlag beobachtet.
Quellen
- ↑ Eintrag zu CAS-Nr. 10034-85-2 im European chemical Substances Information System ESIS
- ↑ Eintrag zu CAS-Nr. 10034-85-2 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 13.01.2008 (JavaScript erforderlich)
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 286-9.
Halogenwasserstoffe: Fluorwasserstoff | Chlorwasserstoff | Bromwasserstoff | Iodwasserstoff | Astatwasserstoff
Halogenwasserstoffsäuren: Fluorwasserstoffsäure | Salzsäure | Bromwasserstoffsäure | Iodwasserstoffsäure
Wikimedia Foundation.
