- KO2
-
Strukturformel Keine Strukturformel vorhanden Allgemeines Name Kaliumhyperoxid Andere Namen Kaliumsuperoxid
Summenformel KO2 CAS-Nummer 12030-88-5 Kurzbeschreibung gelbes Pulver Eigenschaften Molare Masse 71,10 g·mol–1 Aggregatzustand fest
Dichte Schmelzpunkt 380 °C[1]
Siedepunkt Zersetzung
Löslichkeit in Wasser heftige Zersetzung[1]
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 

Brand-
förderndÄtzend (O) (C) R- und S-Sätze R: 8-35 S: 17-26-36/37/39-45 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Kaliumhyperoxid oder Kaliumsuperoxid (KO2) ist eine gelbe, salzartige chemische Verbindung und zählt zu den Hyperoxiden.
Inhaltsverzeichnis
Eigenschaften und Verwendung
Das gelbe Salz zersetzt sich in Wasser lebhaft unter Bildung von Kalilauge, Wasserstoffperoxid und Sauerstoff.
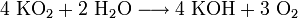
- Kaliumhyperoxid reagiert mit Wasser unter Bildung von Kalilauge und Sauerstoff.
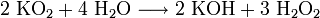
- Kaliumhyperoxid reagiert mit Wasser unter Bildung von Kalilauge und Wasserstoffperoxid.
Kaliumhyperoxid besitzt die Fähigkeit Wasserdampf und Kohlenstoffdioxid zu binden und dafür Sauerstoff an die Umgebung abzugeben.
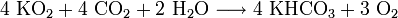
- Kaliumhyperoxid reagiert mit Kohlenstoffdioxid und Wasserdampf unter Bildung von Kaliumhydrogencarbonat und Sauerstoff.
Da sowohl Kohlenstoffdioxid als auch Wasser bei der Atmung abgegeben werden, kann es deshalb beispielsweise in Raumstationen, U-Booten oder in Atemrettungsgeräten zur Regenerierung der Atemluft verwendet werden.
Neben Kaliumhyperoxid wird zum Austausch von Kohlenstoffdioxid gegen Sauerstoff auch Natriumperoxid (Na2O2) benutzt. Ein Vorteil von Natriumperoxid gegenüber Kaliumhyperoxid ist das geringere Gewicht.
Herstellung
Kaliumhyperoxid wird durch Erhitzen von Kalium im Sauerstoffstrom oder in sauerstoffangereicherter Luft hergestellt. Es bildet sich allerdings auch nach folgender Reaktionsgleichung bei der Verbrennung von Kalium an der Luft unter Atmosphärendruck:
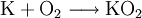
- Kalium reagiert mit Sauerstoff zu Kaliumhyperoxid.
Quellen
Weblinks
Oxide, Peroxide, Hyperoxide und Ozonide der Alkalimetalle: Herstellung, Struktur, Bedeutung
Wikimedia Foundation.
