- Kiliani-Fischer-Synthese
-
Die Kiliani-Fischer-Synthese (auch Cyanhydrin-Synthese) dient zur Verlängerung der Kohlenstoffkette von Zuckern, wie z. B. bei der Reaktion einer Aldopentose zur Aldohexose. Namensgeber sind Heinrich Kiliani[1] und Emil Fischer.[2]
Klassischer Syntheseweg
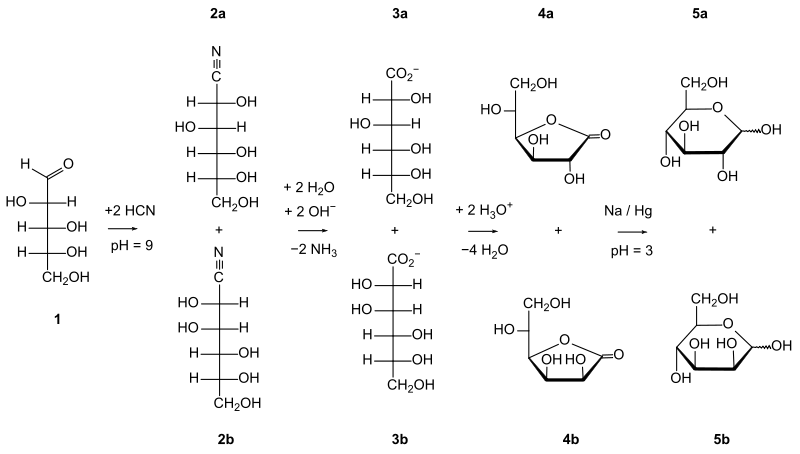
Der Hauptreaktionsweg, der durch Untersuchung der Intermediate im Reaktionsverlauf vorgeschlagen wurde, sieht D-Arabinose → D-Hexononitril (ein Cyanhydrin) → D-Hexonoimidolacton → D-Hexonolacton → D-Hexonsäure vor.[3]
Zunächst kommt es zur Nucleophilen Addition von Blausäure (HCN) an die Carbonylgruppe der Aldose, hier D-Arabinose (1). Da der Angriff auf den Kohlenstoff von zwei Seiten erfolgen kann, bilden sich hierbei zwei diastereomere Cyanhydrine, in diesem Fall 2a D-Gluconsäurenitril und 2b D-Mannonsäurenitril.
Anschließend kommt es zur Hydrolyse des Nitrils zur Carbonsäure. Es entstehen zwei diastereomere Aldonate: 3a D-Gluconat und 3b D-Mannonat. Hierbei handelt es zunächst um eine nucleophile Addition von Wasser an die Dreifachbindung, dann erfolgt eine Umlagerung und schließlich eine nucleophile Substitution, da die Aminogruppe gegen eine Hydroxygruppe ausgetauscht wird, wodurch letztlich die Carbonsäure entsteht.
Im sauren Milieu kommt es zur spontanen Cyclodehydratisierung zu Fünfring-Lactonen (γ-Lactonen): 4a γ-D-Gluconolacton und 4b γ-D-Mannonolacton.
Letzter Schritt ist die Reduktion der Carbonsäure mit Natriumamalgam zum Aldehyd. Dabei wird das Natriumamalgam zu Natriumamalgamoxid oxidiert und es entstehen letztlich zwei epimere Aldohexosen: 5a D-Glucose und 5b D-Mannose.[4]
Moderne Entwicklungen
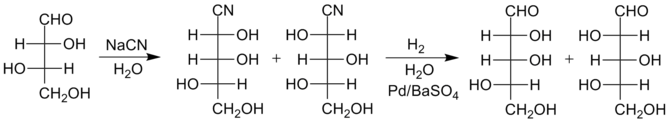
1958 beschrieben R. Kuhn et al.[5] welche speziell für längere Zucker wie Glucose oder Mannose eine höhere Ausbeute ermöglicht. Anstelle der Umsetzung des Cyanhydrins zum Lactam wird dieses mittels reduktiver Hydrierung auf Pd/BaSO4 in Wasser als Lösungsmittel zum Imin umgesetzt. Dieses wiederum hydrolysiert unter den gegebenene Bedingungen augenblicklich zum Aldehyd. Die Verwendung von vergifteten Katalysatoren, etwa Lindlar-Katalysatoren, ist notwendig um die vollständige Reduktion zum Alkohol zu verhindern.
Das Beispiel zeigt die Kettenverlängerung von L-Threose zu L-Xylose and L-Lyxose.
Einzelnachweise
- ↑ Heinrich Kiliani, Über das Cyanhydrin der Lävulose, Berichte der deutschen chemischen Gesellschaft, Volume 18, Issue 2, S.3066-3072, 1885, doi:10.1002/cber.188501802249.
- ↑ Emil Fischer, Reduction von Säuren der Zuckergruppe, Berichte der deutschen chemischen Gesellschaft, Volume 22, Issue 2, S.2204-2205, 1889, doi:10.1002/cber.18890220291.
- ↑ Rajendra Varmaa, Dexter Frencha: Mechanism of the cyanohydrin (Kiliani-Fischer) synthesis. In: Carbohydrate Research. 25, Nr. 1, 1. November 1972, doi:10.1016/S0008-6215(00)82748-2.
- ↑ E. Breitmaier, G. Jung: Organische Chemie, Georg Thieme Verlag Stuttgart, 2005, ISBN 3-13-541505-8.
- ↑ Richard Kuhn, Hans Grassner, Katalytische Hydrierung von Hydroxynitrilen eine Methode, Justus Liebigs Annalen der Chemie, Volume 612, Issue 1, S.55-64, 1957, doi:10.1002/jlac.19586120106.
Wikimedia Foundation.