- Kobaltsulfat
-
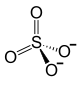
Strukturformel 
Allgemeines Name Cobalt(II)-sulfat Andere Namen - Cobaltsulfat
- Cobaltvitriol
Summenformel CoSO4 bzw. CoSO4 · 7 H2O CAS-Nummer 10124-43-3 (wasserfrei)
16591-12-1 (Hexahydrat)
13455-34-0 (Monohydrat)
10026-24-1 (Heptahydrat))Kurzbeschreibung violettes, hygroskopisches Pulver Eigenschaften Molare Masse 154,99 g·mol−1 Aggregatzustand fest
Dichte 3,71 g·cm−3 (Anhydrat bei 20 ºC )[1]
2,03 g·cm−3 (Heptahydrat)
3,08 g·cm−3 (Monohydrat)[2]Schmelzpunkt 97 ºC[1]
Siedepunkt Zersetzung bei 708 °C[1]
Löslichkeit Anhydrat löslich in Wasser
Heptahydrat leicht löslich in Wasser, Ethanol und MethanolSicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 

Giftig Umwelt-
gefährlich(T) (N) R- und S-Sätze R: 49-60-22-42/43-68-50/53 S: 53-45-60-61 MAK aufgehoben, da cancerogen[1]
LD50 582 mg/kg (Heptahydrat)[4]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Das Cobalt(II)-sulfat ist ein violettes, hygroskopisches Salz der Schwefelsäure. Das giftige, krebserzeugende Pulver nimmt an feuchter Luft Hydratwasser auf und bildet das hellviolette bis karminrote Cobalt(II)-sulfat-Heptahydrat aus. Abhängig von der Temperatur treten auch das Hexahydrat und das Monohydrat auf.
Inhaltsverzeichnis
Vorkommen
Kobalt (II)-sulfat tritt selten in Form von einigen Kristallhydrat-Mineralien entlang der Oxidationszonen von primären Cobaltmineralien (wie Skutterudit oder Cobaltit) auf. Dies sind: Biebierit (Heptahydrat), Moorhouseit (Co,Ni,Mn)SO4·6 H2O, Aplowit (Co,Mn,Ni)SO4·4 H2O und Cobaltkieserit (Monohydrat).
Gewinnung und Darstellung
Es entsteht bei Einwirkung von Schwefelsäure auf elementares Cobalt oder auf Cobaltoxide wie Cobalt(II)-oxid.
Eigenschaften
Cobalt(II)-sulfat bildet orthogonale Kristalle, wogegen das Hepta- und Monohydrat monokline Kristallstrukturen ausbildet[2]. Das Heptahydrat spaltet bei 41,5 °C Kristallwasser ab und bildet das violette Hexahydrat. Dieses wiederum setzt sich durch Abspaltung von Kristallwasser bei 71 °C zum roten Monohydrat um.
Verwendung
Cobalt(II)-sulfat wird zur Herstellung von Pigmenten, Glasuren, in der Porzellanmalerei, zur Tonung von Papieren (Fotographie), in Bädern für Cobalt-Electroplating und zur Spurenelementsupplementierung in der Aquaristik u.a. verwendet.
Quellen
- ↑ a b c d Eintrag zu Cobalt(II)-sulfat in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 13.1.2008 (JavaScript erforderlich)
- ↑ a b SLAC: PHYSICAL CONSTANTS OF INORGANIC COMPOUNDS
- ↑ Eintrag zu CAS-Nr. 10124-43-3 im European chemical Substances Information System ESIS
- ↑ Sicherheitsdatenblatt (Merck)
Wikimedia Foundation.

