- Cobalt(II)-oxid
-
Kristallstruktur 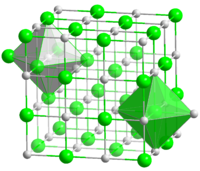
__ Co2+ __ O2− Allgemeines Name Cobalt(II)-oxid Andere Namen - Cobaltmonoxid
- Kobalt(II)-oxid
Verhältnisformel CoO CAS-Nummer 1307-96-6 PubChem 14786 Kurzbeschreibung olivgrüner Feststoff[1]
Eigenschaften Molare Masse 74,93 g·mol−1[1] Aggregatzustand fest
Dichte 6,45 g·cm−3[1]
Schmelzpunkt Löslichkeit unlöslich in Wasser (3,13 mg·l−1)[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [2] 

Achtung
H- und P-Sätze H: 302-317-410 EUH: keine EUH-Sätze P: 273-280-501 [3] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 

Gesundheits-
schädlichUmwelt-
gefährlich(Xn) (N) R- und S-Sätze R: 22-43-50/53 S: (2)-24-37-60-61 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Cobalt(II)-oxid ist eines von mehreren Oxiden des chemischen Elementes Cobalt. Es ist ein olivgrünes, in Wasser unlösliches Salz.
Inhaltsverzeichnis
Gewinnung und Darstellung
Cobalt(II)-oxid entsteht, wenn elementares Cobalt an der Luft oder Cobalt(II)-nitrat, Cobalt(II)-hydroxid oder Cobalt(II)-carbonat unter Luftabschluss erhitzt werden.
Eigenschaften
Die Verbindung kristallisiert in der Natriumchlorid-Struktur, also im kubischen Kristallsystem in der Raumgruppe
 . Der Gitterparameter beträgt a = 424,9 pm, in der Elementarzelle befinden sich vier Formeleinheiten.[4] Meist kommt (ähnlich wie bei Eisen(II)-oxid FeO) ein leichter Cobalt-Unterschuss vor. Trocken ist Cobaltoxid beständig, feucht kann es leicht zu Cobaltoxidhydroxid CoO(OH) oxidiert werden. Unterhalb von 16 °C ist die Verbindung antiferromagnetisch.[5]
. Der Gitterparameter beträgt a = 424,9 pm, in der Elementarzelle befinden sich vier Formeleinheiten.[4] Meist kommt (ähnlich wie bei Eisen(II)-oxid FeO) ein leichter Cobalt-Unterschuss vor. Trocken ist Cobaltoxid beständig, feucht kann es leicht zu Cobaltoxidhydroxid CoO(OH) oxidiert werden. Unterhalb von 16 °C ist die Verbindung antiferromagnetisch.[5]Wird es an der Luft auf 400–500 °C erhitzt, bildet sich Cobalt(II,III)-oxid.
Verwendung
Cobalt(II)-oxid wird als Rohstoff für die Herstellung von Pigmenten in der Keramikindustrie (Thénards Blau) verwendet.
Einzelnachweise
- ↑ a b c d e Eintrag zu Cobalt(II)-oxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 13.06.2007 (JavaScript erforderlich)
- ↑ a b Eintrag zu CAS-Nr. 1307-96-6 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ Datenblatt Cobalt(II) oxide bei Sigma-Aldrich, abgerufen am 23. März 2011.
- ↑ Jean D'Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, Band 3. 4. Auflage, Springer, 1997, ISBN 978-3-540-60035-0, S. 386 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ P. S. Silinsky, M. S. Seehra: „Principal magnetic susceptibilities and uniaxial stress experiments in CoO“, in: Phys. Rev. B, 1981, 24, S. 419–423; doi:10.1103/PhysRevB.24.419
Literatur
- Holleman-Wiberg: Lehrbuch der Anorganischen Chemie 102. Auflage, de Gruyter, Berlin, 2007, ISBN 978-3-11-017770-1.
- N. N. Greenwood, A. Earnshaw: Chemie der Elemente, VCH Verlagsgesellschaft, 1. Auflage 1988, ISBN 3-527-26169-9
Kategorien:- Gesundheitsschädlicher Stoff
- Sensibilisierender Stoff
- Umweltgefährlicher Stoff
- Oxid
- Cobaltverbindung
Wikimedia Foundation.



