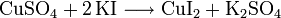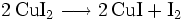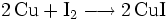- Kupfer(I)iodid
-
Kristallstruktur 
__ Cu+ __ I- Allgemeines Name Kupfer(I)-iodid Andere Namen Kupferjodür
Verhältnisformel CuI CAS-Nummer 7681-65-4 Kurzbeschreibung graues bis weißes Pulver (wasserfrei)[1]
blassgrün (Hydrat)Eigenschaften Molare Masse 190,44 g·mol−1 Aggregatzustand fest
Dichte Schmelzpunkt Siedepunkt 1290 °C[1]
Dampfdruck 13,3 mbar bei 656 °C[1]
Löslichkeit Sicherheitshinweise Gefahrstoffkennzeichnung [1] 

Gesundheits-
schädlichUmwelt-
gefährlich(Xn) (N) R- und S-Sätze R: 22-37-41-50/53 S: 22-26-36/37/39-57-60-61 MAK 0,1 mg/m3[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Kupfer(I)-iodid ist das Kupfersalz der Iodwasserstoffsäure. Wasserfreies Kupfer(I)-iodid ist ein graues bis weißes Pulver, als Hydrat ist es leicht grünlich, wie es typisch für einwertige Kupfersalze ist.
Inhaltsverzeichnis
Eigenschaften
Aufgrund der Elektronenkonfiguration d10 sind Kupfer(I)-Verbindungen diamagnetisch. Kupferiodid kristallisiert in der Sphaleritstruktur.[2]
Struktur
Kupferiodid ist – wie die meisten zweiatomigen Metallhalogenide – ein anorganisches Polymer. Es hat ein reichhaltiges Phasendiagramm, welches besagt, dass es in multiplen, kristallinen Formen vorkommt. Kupferiodid ist tetraedrisch koordiniert, wenn es sich in der Zinkblendestruktur befindet. Der Atomabstand zwischen Kupfer- und Iodatom beträgt 2,338 Å.[3]
Gewinnung und Darstellung
Im Labor kann Kupfer(I)-iodid durch Mischen eines Kupfer(II)-salzes (meist Kupfersulfatlösung) und einer Kaliumiodidlösung hergestellt werden. Dabei entsteht Kupfer(II)iodid:
Dieses ist sehr unbeständig und zerfällt sofort:
Bei der industriellen Herstellung wird Iod-Dampf auf Kupfermetall geleitet:
Quellenangaben
- ↑ a b c d e f g h Eintrag zu CAS-Nr. 7681-65-4 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 08. Dez 2007 (JavaScript erforderlich)
- ↑ Erwin Riedel, „Anorganische Chemie“, 4. Auflage, de Gruyter Verlag, ISBN 311016602X
- ↑ Wells, A. F. Structural Inorganic Chemistry Oxford University Press, Oxford, (1984). 5th ed., p. 410 and 444.
Wikimedia Foundation.

-iodid.JPG)
_iodide.jpg)