- Kynurenin-3-Monooxygenase
-
Kynurenin-3-Monooxygenase —
Masse/Länge Primärstruktur 486 Aminosäuren Sekundär- bis Quartärstruktur multipass Membranprotein Kofaktor FAD Isoformen 3 Bezeichner Gen-Name KMO Externe IDs OMIM: 603538 UniProt: O15229 Enzymklassifikation EC, Kategorie 1.14.13.9 Monooxygenase Reaktionsart Hydroxylierung Substrat Kynurenin + NADPH + O2 Produkte 3-Hydroxykynurenin + NADP+ + H2O Vorkommen Homologie-Familie Kynureninmonooxygenase Übergeordnetes Taxon Bakterien, Pilze, Tiere Kynurenin-3-Monooxygenase (KMO) heißt dasjenige Enzym, das die Hydroxylierung von Kynurenin zu 3-Hydroxykynurenin katalysiert. Diese Reaktion ist ein Teilschritt im Katabolismus der Aminosäure Tryptophan und der Synthese von NAD und neurologisch aktiver Stoffe. KMO kommt in Tieren und manchen Pilzen und Bakterien vor. Beim Menschen ist sie in größeren Mengen in Leber, Plazenta und im Immunsystem lokalisiert, wobei sie in der Membran der Mitochondrien verankert ist und ins Zytosol ragt. KMO ist Target bei neurodegenerativen Erkrankungen, da ihre Hemmung die Menge des neuroprotektiven NMDA-Rezeptor-Antagonisten Kynurenin erhöht.[1][2][3][4]
Hochregulation der KMO bei pneumokokkaler Meningitis und folgende Anhäufung des neurotoxischen 3-Hydroxykynurenin tragen zu den neurologischen Schäden durch diese Infektionskrankheit bei. Mit cerebraler Malaria befallene Mäuse lebten dreimal so lang, wenn ihre KMO gehemmt wurde. Eine Rolle bei Chorea Huntington wird diskutiert.[5][6][7]
Katalysierte Reaktion
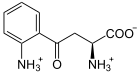
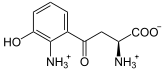
L-Kynurenin wird unter Verbrauch von NADPH und Sauerstoff zu 3-Hydroxy-L-kynurenin umgesetzt.
Einzelnachweise
- ↑ UniProt O15229
- ↑ Hamann M, Sander SE, Richter A: Effects of the kynurenine 3-hydroxylase inhibitor Ro 61-8048 after intrastriatal injections on the severity of dystonia in the dt sz mutant. In: Eur. J. Pharmacol.. 586, Nr. 1-3, Mai 2008, S. 156–9. doi:10.1016/j.ejphar.2008.02.052. PMID 18353306.
- ↑ Grégoire L, Rassoulpour A, Guidetti P, et al: Prolonged kynurenine 3-hydroxylase inhibition reduces development of levodopa-induced dyskinesias in parkinsonian monkeys. In: Behav. Brain Res.. 186, Nr. 2, Januar 2008, S. 161–7. doi:10.1016/j.bbr.2007.08.007. PMID 17868931.
- ↑ Poeggeler B, Rassoulpour A, Wu HQ, Guidetti P, Roberts RC, Schwarcz R: Dopamine receptor activation reveals a novel, kynurenate-sensitive component of striatal N-methyl-D-aspartate neurotoxicity. In: Neuroscience. 148, Nr. 1, August 2007, S. 188–97. doi:10.1016/j.neuroscience.2007.05.033. PMID 17629627. Volltext bei PMC: 2034343.
- ↑ Bellac CL, Coimbra RS, Christen S, Leib SL: Pneumococcal meningitis causes accumulation of neurotoxic kynurenine metabolites in brain regions prone to injury. In: Neurobiol. Dis.. 24, Nr. 2, November 2006, S. 395–402. doi:10.1016/j.nbd.2006.07.014. PMID 16956766.
- ↑ Clark CJ, Mackay GM, Smythe GA, Bustamante S, Stone TW, Phillips RS: Prolonged survival of a murine model of cerebral malaria by kynurenine pathway inhibition. In: Infect. Immun.. 73, Nr. 8, August 2005, S. 5249–51. doi:10.1128/IAI.73.8.5249-5251.2005. PMID 16041050. Volltext bei PMC: 1201246.
- ↑ Giorgini F, Guidetti P, Nguyen Q, Bennett SC, Muchowski PJ: A genomic screen in yeast implicates kynurenine 3-monooxygenase as a therapeutic target for Huntington disease. In: Nat. Genet.. 37, Nr. 5, Mai 2005, S. 526–31. doi:10.1038/ng1542. PMID 15806102. Volltext bei PMC: 1449881.
Weblinks
Wikimedia Foundation.