- Chorea Huntington
-
Klassifikation nach ICD-10 G10 Chorea Huntington
Chorea chronica progressiva hereditariaF02.2* Demenz bei Chorea Huntington ICD-10 online (WHO-Version 2011) Die Chorea major (Huntington) auch als Huntington-Chorea oder Huntington-Krankheit bezeichnet (älterer Name: Veitstanz) ist eine bis heute unheilbare vererbliche Erkrankung des Gehirns. Oft wird sie – auch im Deutschen – mit HD abgekürzt, was für engl. Huntington's disease steht.
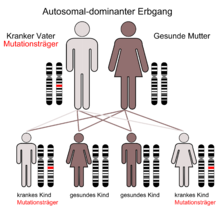
Es ist eine autosomal-dominant vererbte, neuro-degenerative Erkrankung, die meist um das 40. Lebensjahr zu ersten Krankheitssymptomen – Bewegungsstörungen und psychische Symptome – führt. Männer und Frauen sind in gleicher Häufigkeit betroffen. Die Krankheit nimmt immer einen schweren Verlauf und führt im Durchschnitt 15 Jahre nach den ersten Symptomen zum Tod. Homozygote (gleicherbige) Mutationsträger, d. h. solche mit zwei mutierten Allelen (Gen-Strängen) sind nicht stärker betroffen als heterozygote (verschiedenerbige) und mit wenigen Ausnahmen erkranken alle Merkmalsträger früher oder später (vollständige Penetranz). Die Chorea Huntington ist eine der häufigsten erblich bedingten Hirnstörungen mit einer Inzidenz von 5:100.000. Diese schwankt jedoch von Land zu Land erheblich und liegt beispielsweise in Japan bei 1:100.000. Seit 1993 lässt sich das die Krankheit verursachende Allel auf dem kurzen Arm des vierten Chromosoms (Genlocus p16.3)[1] nachweisen, auch beim Ungeborenen durch Amniozentese oder Chorionzottenbiopsie.
Inhaltsverzeichnis
Herkunft des Namens
Die Chorea Huntington (chorea, gr. χορεία = Tanz) wurde 1872 von dem New Yorker Arzt George Huntington ausführlich beschrieben. Er beschrieb eine klinische Trias, die lange Zeit Gültigkeit hatte:
- erblich (hereditary nature)
- psychiatrische Auffälligkeiten und Suizidneigung (insanity and suicide)
- schwere Symptome nur im Erwachsenenalter (only in adult life)
Das letzte Kriterium stellte sich später als falsch heraus. Huntington nahm anfangs an, dass die Ausbreitung von Chorea Huntington auf Long Island (Vereinigte Staaten) beschränkt sei. Tatsächlich war sie aber bereits damals weltweit anzutreffen. Der deutsche Name ist erblicher Veitstanz. Die Bezeichnung Veitstanz ist seit dem 16. Jahrhundert bezeugt und hat ihren Ursprung darin, dass als Helfer der heilige Veit (Vitus) angerufen wurde. Wieso gerade dieser Heilige angerufen wurde, ist nicht bekannt.
Mittlerweile ist in allen ärztlichen und sonstigen Fachkreisen der Begriff Chorea Huntington als Bezeichnung üblich.
Pathophysiologie
Genetik
Chorea Huntington ist eine autosomal dominant vererbte Krankheit. Dies bedeutet, dass die Nachkommen eines Betroffenen mit einer Wahrscheinlichkeit von mindestens 50 % ebenfalls betroffen sein können – je nachdem, ob der phänotypisch erkrankte Elternteil ein oder zwei mutierte Allele besitzt (zwei mutierte Allele = 100 % Wahrscheinlichkeit für eine Erkrankung). Generationensprünge kommen nicht vor, Männer und Frauen sind gleich häufig betroffen. Davon abweichend liegt bei ca. 5 % bis 10 % der Patienten eine Neumutation vor. Das Protein, das die Krankheit verursacht, heißt Huntingtin, das dafür codierende Gen liegt auf dem kurzen Arm von Chromosom 4 (Genlocus p16.3). Chorea Huntington ist eine Trinukleotiderkrankung: Bei gesunden Menschen wiederholt sich das Basentriplett CAG circa 9 bis 35 Mal. Bei Kranken kommt dieses Triplett von 36 bis zu 250 Mal vor. Dies wird vor allem durch sogenannte „slippage“ (ein Verrutschen der DNA-Polymerase bei der Replikation) oder (unwahrscheinlicher, aber immerhin möglich) durch ein nichtreziprokes (asymmetrisches) Crossing-over verursacht. Je häufiger sich diese Wiederholung ereignet, desto früher tritt die Erkrankung (im Durchschnitt) auf (Antizipationseffekt). Bei Menschen mit einer Anzahl von 36 bis 40 CAG-Wiederholungen gilt eine Ausnahme zur vollständigen Penetranz der Krankheit, das heißt nicht alle Menschen dieses Genotyps entwickeln die Krankheit und auch nach einem Gentest sind keine definitiven Vorhersagen möglich.[2] Die juvenile Chorea Huntington manifestiert sich bei über 60 CAG-Tripletts. Ein Ausbruch im vierten Lebensjahr ist beschrieben. Bei Vererbung durch den Vater erhöht sich die Zahl der CAG-Tripletts häufiger als bei Vererbung durch die Mutter (Imprinting-Phänomen). Meist findet sich bei einem Elternteil eines Betroffenen mit Neumutation schon eine Anzahl von 30 bis 35 Wiederholungen (Prämutation).
Molekularbiologie
Die aus dem Triplett CAG resultierende mRNA codiert für die Aminosäure Glutamin. Das mutierte Huntingtin besitzt also mehr als die übliche Anzahl an aneinandergereihten Glutamin-Resten. Möglicherweise handelt es sich dabei um eine „Gain-of-Function-Mutation“, das heißt die normale Funktion des Huntington-Proteins könnte erhalten bleiben, zusätzlich jedoch erhält es weitere – toxische – Eigenschaften. Eine hohe Expression von Huntingtin führt zu amyloidähnlichen Ablagerungen (inclusions) von mutiertem Huntingtin, wahrscheinlich auch deshalb, weil der Abbau des mutierten Proteins durch das Proteasom nicht mehr richtig funktioniert. Andererseits wurde auch eine Toxizität des freien mutierten Huntingtins von einigen Arbeitsgruppen nachgewiesen, so dass die Huntington-Aggregate als Schutz angesehen werden können. Die betroffenen Zellen haben einen gestörten Glucosestoffwechsel. Dies führt zu einer gesteigerten Empfindlichkeit gegenüber oxidativem Stress und dem erregenden Neurotransmitter Glutamat. Diese Zellen besitzen besonders viele Glutamatrezeptoren und haben viele eingehende glutamaterge Verbindungen. Trotzdem ist derzeit nur unbefriedigend erklärbar, warum die Toxizität nur in den beschriebenen Arealen nachweisbar ist, obwohl Huntingtin in allen kernhaltigen Zellen gebildet wird.
Die physiologische Funktion von Huntingtin ist trotz intensiver Forschung noch nicht vollständig geklärt. Es gibt eine Reihe von Hinweisen dafür, dass es eine wichtige Rolle beim intrazellulären Transport von Vesikeln und Organellen spielt.[3] Huntingtin hat funktionelle Ähnlichkeiten mit Ataxin-2. Ataxin-2 ist ein Protein, welches eine andere Polyglutaminerkrankung auslöst, nämlich die Spinozerebelläre Ataxie Typ 2.
Neuroanatomie und Physiologie
Betroffen ist vor allem das Putamen, welches ein Teil des Corpus striatum in den Basalganglien ist und über einen direkten und über einen indirekten Pfad Einfluss auf den Globus pallidus internus nehmen kann.
Der indirekte wirkt dem direkten Pfad entgegen. Der insgesamt hemmende Effekt des indirekten Pfades wird im Gesunden über folgende Stationen erreicht: Die bewegungs-hemmenden Anteile des Striatums hemmen ihrerseits den Globus pallidus pars lateralis/externus. Dieser verringert nun seinen hemmenden Effekt auf den Nucleus subthalamicus wodurch dessen Aktivität verstärkt wird. Da der Nucleus subthalamicus glutamaterge Efferenzen zum medialen Pallidum besitzt, fördert er dessen hemmende Wirkung auf den Thalamus.
Bei Menschen mit Chorea Huntington degenerieren in erster Linie GABA/Enkephalin-erge Neurone, d. h. der Anfang des indirekten Pfades ist zerstört. Dies hat zur Folge, dass der Globus pallidus internus über den direkten Weg stärker gehemmt wird als bei gesunden Menschen. Da der Globus pallidus internus seinerseits normalerweise den Thalamus inhibiert, wird dieser nun weniger gehemmt, also aktiviert (= Disinhibition). Die Konsequenz ist eine Übererregung des Thalamus und des Cortex.[4]
Da die indirekten Verbindungen im Verlauf meist zuerst zerstört werden, steht am Anfang der Erkrankung eine Überaktivierung mit überschießenden Bewegungen im Vordergrund. Im weiteren Verlauf gehen auch die direkten Verbindungen verloren und es dominieren Bewegungsarmut (Akinese) und Steifheit (Rigor).
Krankheitsbild
Verlauf
Erste Symptome der Krankheit zeigen sich meist zwischen dem 30. und 40. Lebensjahr. Das Auftreten von Symptomen ist zwischen dem dritten und dem 75. Lebensjahr beschrieben worden. Patienten mit einem frühen Krankheitsbeginn leiden häufig unter einem schwereren Krankheitsverlauf. Psychische Beschwerden gehen den Bewegungsstörungen oft mehrere Jahre voraus. Die Bewegungsstörungen beginnen meist mit Hyperkinesien (ungewollten Bewegungen) bei verringertem Muskeltonus. Später zeigen sich eher Hypokinesie (Bewegungsarmut) und Erhöhung des Muskeltonus. Eine Verlaufsform, bei der die Bewegungsarmut von Anfang an im Vordergrund steht, wird Westphal-Variante genannt und tritt häufiger bei frühem Krankheitseintritt auf. Die Chorea Huntington dauert bis zu 20 Jahren und endet danach tödlich. Das Voranschreiten der Krankheit kann durch Stress beschleunigt werden, umgekehrt haben günstige Lebensumstände mit einer leidensgerechten Aktivierung einen günstigen Einfluss auf den Verlauf der Erkrankung.
Psychische Beschwerden und psychiatrische Symptome
Zu den ersten Erscheinungen der psychischen Veränderung gehören meist Störungen des Affektes und des Antriebes. Diese können auch den Bewegungsstörungen vorangehen. Später können ein unbedachtes und impulsives Verhalten sowie eine Enthemmung in zwischenmenschlichen Beziehungen auftreten. Aufgrund der mangelhaften Kontrolle über die Muskulatur (z. B. des Gesichtes mit Grimassieren) kann der falsche Eindruck eines bereits fortgeschrittenen Persönlichkeitsverlustes entstehen, was bei den Patienten Resignation und Depressionen hervorruft. Besonders in der Frühphase der Erkrankung kann dies zu suizidalem Verhalten führen. Früh treten auch Störungen der visuellen Informationsverarbeitung auf, was z. B. dazu führt, dass die Kranken insbesondere kritische Gesichtsausdrücke ihrer Mitmenschen – wie z. B. Verärgerung – nicht richtig wahrnehmen und so darauf nicht angemessen reagieren können. Im Frühstadium werden leichte Beeinträchtigungen der intellektuellen Fähigkeiten sowie Gedächtnisstörungen oft übersehen. Im Spätstadium der Erkrankung entwickeln die Patienten eine subkortikale Demenz, d. h. es kommt zum Verlust ihrer kognitiven Fähigkeiten.[5] So finden sich Störungen der Merkfähigkeit, damit im Zusammenhang stehend eine Desorientierung und eine Sprachverarmung. Einige Patienten entwickeln Wahnvorstellungen, die dazu führen, dass sie in psychiatrischen Kliniken behandelt werden (psychisch betonter Verlauf).
Bewegungsstörungen
Die Chorea beginnt meist mit einer zunächst kaum bemerkbaren Bewegungsunruhe der Arme und Beine, des Gesichtes, später des Kopfes sowie des Rumpfes. Diese Unruhe kann sich zu heftigen choreatischen Hyperkinesien steigern. Das sind plötzlich einsetzende, unwillkürliche Bewegungen verschiedener Muskeln, wodurch die Willkürbewegungen unterbrochen werden. Betroffene versuchen zunächst, die choreatischen Bewegungen zu verbergen, indem sie diese in willkürliche Bewegungsabläufe einbauen, z. B. streichen sich nach einer einschießenden Beugebewegung des Armes über das Haar. Zunehmend geraten die Muskelbewegungen aber außer Kontrolle. Beim Vollbild der Erkrankung kommt es zum plötzlichen Grimassieren und zu schleudernden Bewegungen (Chorea) von Armen und Beinen. Sprechen und Schlucken fallen zunehmend schwer (Dysarthrie und Dysphagie). Typischerweise beginnen diese Hyperkinesien in den rumpffernen Teilen der Extremitäten (in den Händen und im Gesicht), so wird der Mund weit geöffnet, die Zunge weit herausgestreckt und sofort wieder zurückgezogen („Chamäleonzunge“). Im weiteren Verlauf sind auch die rumpfnahen Extremitätenanteile betroffen. Bei Auslösen des Kniesehnenreflexes bleibt das Knie gestreckt (Gordon-Phänomen). Die Bewegungsunruhe verstärkt sich unter seelischer und körperlicher Belastung. Obwohl die unkontrollierten Bewegungen im Schlaf aufhören, nehmen sie bei Ermüdung eher zu. Die anfangs choreatischen Hyperkinesien wandeln sich mit zunehmendem Krankheitsverlauf in Dystonien, wobei durch Erhöhung der Muskelspannung (Muskeltonus) die Gliedmaßen minuten- bis stundenlang in einer manchmal schmerzhaften Fehlstellung verharren. An Stelle des Grimassierens tritt dann eventuell eine Anarthrie auf, d. h. es kann eine völlige Unfähigkeit bestehen, Sprechbewegungen auszuführen und der Patient ist nicht mehr in der Lage, durch Mimik, Gestik und Sprache zu reagieren. Das Schlucken fällt den Patienten immer schwerer und kann zu lebensbedrohlichen Komplikationen führen, zumal die Patienten durch die Hyperkinesien einen erhöhten Energieverbrauch haben. Dieser kann sich im Endstadium der Erkrankung auf mehr als das Fünffache des normalen Grundumsatzes erhöhen, so dass eine adäquate Versorgung nur noch mit ergänzender parenteraler Nahrungszufuhr möglich ist.
Unabhängig von der Chorea zeigen Menschen mit Chorea Huntington einen Mangel an motorischer Persistenz, also einen unstetigen Muskeltonus. Dieser wird im Englischen auch treffend als milkmaid's grip umschrieben. Diese Unstetigkeit des Muskeltonus eignet sich besser zur Diagnose des Krankheitsfortschrittes als die Chorea, denn im Gegensatz zur Chorea nimmt sie im Verlauf der Krankheit stetig zu.[2]
Diagnostik
Die Diagnose kann meist klinisch anhand der Symptome gestellt werden. Darüber hinaus besteht die Möglichkeit, die Diagnose durch genetische Analyse zu sichern, auch schon bevor sich die ersten Symptome zeigen, sogar vor der Geburt. Weitere Möglichkeiten sind eine Kernspintomographie oder Computertomographie. Sie zeigen eine Atrophie des Corpus striatum und hier vor allem des Nucleus caudatus. Diese Atrophie führt zu einer Erweiterung der Seitenventrikel. In der 18FDG-PET zeigt sich eine Störung des Glukosestoffwechsels im Corpus striatum. Eine mögliche Differenzialdiagnose ist CJD (Creutzfeldt-Jakob-Krankheit) sowie vCJD (variant CJD).
Ethische Probleme der humangenetischen Diagnostik
Es ist heute möglich, weit vor dem Auftreten jeglicher Symptome bei Menschen aus betroffenen Familien eindeutig festzustellen, ob sie den zur Chorea Huntington führenden Gendefekt haben oder nicht. Während für Kinder eines betroffenen Elternteils ohne weitere Informationen die Wahrscheinlichkeit des Auftretens der Erkrankung bei 50 % liegt, ist nach einer solchen Diagnostik eindeutig geklärt, ob der betreffende Mensch entweder niemals oder aber mit Sicherheit die Erkrankung bekommen wird. Die Entscheidung darüber, ob eine solche Diagnostik gewünscht wird, ist höchst persönlich und kann nur nach einer umfassenden Aufklärung getroffen werden. Zugleich muss berücksichtigt werden, dass mit einer solchen Diagnostik auch Informationen über andere Blutsverwandte bekannt werden.
Therapie
Eine Therapie, welche die Krankheit an sich heilt oder dauerhaft aufhält, ist nicht bekannt. Verschiedene Vitamine und Nahrungsergänzungsmittel werden mit unterschiedlichem Erfolg eingesetzt, um die Zellen vor oxidativem Stress zu schützen und so den Krankheitsverlauf zu verlangsamen. Das Medikament Riluzol vermindert die Glutamatausschüttung und soll den Verlauf verlangsamen. Sämtliche Therapien werden flankiert von physiotherapeutischer, ergotherapeutischer und logopädischer Behandlung zur Besserung der Bewegungsfähigkeit beziehungsweise der Sprache und Schluckfähigkeit. Gleichzeitig sollten der Patient und auch seine Angehörigen psychologisch bzw. bei psychiatrischen Störungen auch psychiatrisch behandelt werden. Die Ernährung sollte den erhöhten Energiebedarf, die Schluckbeschwerden und den erhöhten Zuckerbedarf der Patienten berücksichtigen. Einzelne Symptome können ebenfalls je nach Bedarf behandelt werden.
Behandlung der Bewegungsstörungen
Gegen Hyperkinesien werden neben Tetrabenazin auch Dopamin-Antagonisten eingesetzt, meist Tiaprid oder auch Sulpirid. Bei einsetzendem Rigor werden Dopamin-Agonisten oder L-Dopa eingesetzt, können jedoch die Hyperkinesien verstärken. Daher wird die medikamentöse Therapie erst eingeleitet, wenn die Bewegungsstörungen den Patienten im Alltag stark beeinträchtigen.
Behandlung psychischer Symptome
Bei psychotischen Symptomen wird auf atypische Neuroleptika zurückgegriffen, gegen depressive Symptome vor allem Antidepressiva aus der Gruppe der SSRIs. Bei Schlafstörungen und Angstzuständen können Benzodiazepine zum Einsatz kommen.
Neuroprotektive Behandlung
Es gibt Studien, die eine neuroprotektive Wirkung von Gabapentin auf Patienten mit Chorea Huntington implizieren. Durch dieses Medikament soll die Excitotoxizität des Glutamats auf die Nervenzelle reduziert werden.[6][7]
Einzelnachweise
- ↑ Darstellung des Gens im NCBI Map Viewer
- ↑ a b F. O. Walker: Huntington's disease. In: Lancet. Band 369, Nummer 9557, Januar 2007, S. 218–228, ISSN 1474-547X. doi:10.1016/S0140-6736(07)60111-1. PMID 17240289. (Review).
- ↑ J. P. Caviston, E. L. Holzbaur: Huntingtin as an essential integrator of intracellular vesicular trafficking. In: Trends in cell biology. Band 19, Nummer 4, April 2009, S. 147–155, ISSN 1879-3088. doi:10.1016/j.tcb.2009.01.005. PMID 19269181. PMC 2930405. (Review).
- ↑ Mahlon R. DeLong: The Basal Ganglia. In: Eric R. Kandel, James H. Schwartz und Thomas M.Jessell: Principles of Neural Science. 2000, ISBN 0-838-57701-6, S. 860.
- ↑ K. K. Zakzanis: The subcortical dementia of Huntington's disease. In: Journal of clinical and experimental neuropsychology. Band 20, Nummer 4, August 1998, S. 565–578, ISSN 1380-3395. doi:10.1076/jcen.20.4.565.1468. PMID 9892059.
- ↑ D. Bonekamp: 1H-Magnetresonanzspektroskopie bei Chorea Huntington unter neuroprotektiver Therapie mit Gabapentin. Dissertation, Medizinische Fakultät Charité – Universitätsmedizin Berlin, 2004.
- ↑ C. Cosentino, L. Torres, J. M. Cuba: Gabapentin for Huntington's disease. In: J Neurology. Band 243, 1996, S: p;S75-S76.
Weiterführende Literatur
- R. A. Roos: Huntington's disease: a clinical review. In: Orphanet journal of rare diseases. Band 5, Nummer 1, 2010, S. 40, ISSN 1750-1172. doi:10.1186/1750-1172-5-40. PMID 21171977. PMC 3022767. (Review). (Open Access)
- I. Shoulson, A. B. Young: Milestones in huntington disease. In: Movement disorders. Band 26, Nummer 6, Mai 2011, S. 1127–1133, ISSN 1531-8257. doi:10.1002/mds.23685. PMID 21626556. (Review).
- A. L. Southwell, P. H. Patterson: Gene therapy in mouse models of huntington disease. In: The Neuroscientist. Band 17, Nummer 2, April 2011, S. 153–162, ISSN 1089-4098. doi:10.1177/1073858410386236. PMID 21489966. PMC 3131092. (Review).
- D. Eidelberg, D. J. Surmeier: Brain networks in Huntington disease. In: The Journal of clinical investigation. Band 121, Nummer 2, Februar 2011, S. 484–492, ISSN 1558-8238. doi:10.1172/JCI45646. PMID 21285521. PMC 3026742. (Review).
- J. Rutishauser: Morbus Huntington: disrupt the fatal attraction. In: Schweiz Med Forum. 24, 2002, S. 586–587.
- E. Cattaneo u. a: Das Rätsel der Chorea Huntington. In: Spektrum der Wissenschaft. 2004, S. 60–66.
Weblinks
- Leitlinie Chorea der Deutschen Gesellschaft für Neurologie. In: AWMF online (Stand 10/2005)
- Links zum Thema Chorea Huntington im Open Directory Project
- Genetics Home Reference: Huntingtondisease

Bitte den Hinweis zu Gesundheitsthemen beachten!
Wikimedia Foundation.